
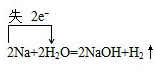 ,反应中H2O是氧化剂,氢气是还原产物,摩尔质量是:2g/mol,故答案为:
,反应中H2O是氧化剂,氢气是还原产物,摩尔质量是:2g/mol,故答案为: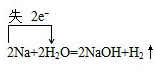 ;H2O;2g/mol;
;H2O;2g/mol;

科目:高中化学 来源: 题型:
| c(OH-) |
| c(H+) |
| A、该溶液中由水电离产生的c(H+)=1×10-8mol/L |
| B、0.01mol/LHA的溶液中c(H+)=1×10-4mol/L |
| C、1体积pH=3的HA与10体积pH=11的NaOH混合后溶液中c(OH-)+c(A-)═c(H+)+c(Na+) |
| D、浓度均为0.1 mol/L的HA溶液和NaA溶液等体积混合后所得溶液显酸性,则c(OH-)-c(H+)<c(HA)-c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用纸上层析法分离和检验墨水的成分,为了看到色斑,只有有色离子的检验才可以用纸层析法 |
| B、容量瓶、量筒、滴定管上都具体标明使用温度,容量瓶有标线无“0”刻度,量筒、滴定管都有“0”刻度;使用时容量瓶水洗后不用润洗,量筒、滴定管水洗后还需润洗 |
| C、溴水中加入苯,溴水褪色了是因为溴与苯发生了取代反应,溴水中通入乙烯,溴水褪色了是因为溴与乙烯发生了加成反应 |
| D、物质的分离提纯方法之一为“筛分”:如胶体-渗析法分离提纯;浊液-过滤分离,本质上就是依据所分离粒子的直径大小选择具有合适孔径的“筛子” |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、活性炭、SO2、氯水都会因发生氧化还原反应而使品红溶液褪色 |
| B、Na2O2、H2O2所含化学键完全相同,都能作供氧剂 |
| C、常温下,浓硫酸、浓硝酸与铝均能发生钝化,均能用铝罐储运 |
| D、水玻璃,从分类法的角度,可看作纯净物,可用于木材等的防火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 25 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
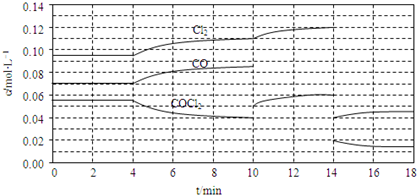
查看答案和解析>>
科目:高中化学 来源: 题型:
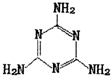 Ⅰ.CN-能与Ni2+形成[Ni(CN)4]2-配离子
Ⅰ.CN-能与Ni2+形成[Ni(CN)4]2-配离子查看答案和解析>>
科目:高中化学 来源: 题型:
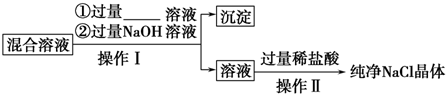
查看答案和解析>>
科目:高中化学 来源: 题型:
A、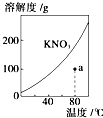 如图表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 |
B、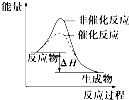 如图表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
C、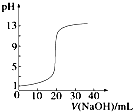 如图表示0.1000mol?L-1 NaOH溶液滴定20.00mL 0.1000mol?L-1醋酸溶液得到的滴定曲线 |
D、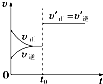 如图表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件可能是增大压强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com