
| A. | 该电池的负极反应方程式为Zn-2e-+3OH-=HZnO2-+H2O | |
| B. | 当负极减重65g时,正极消耗O2的体积为11.2L | |
| C. | 电池在放电过程中阳离子移向负极,阴离子移向正极 | |
| D. | 随着放电过程进行,电池正极区域附近pH减小 |
分析 A、总反应的离子方程式为2Zn+2OH-+O2=2HZnO2-,在碱性环境下,正极反应式为:O2+2H2O+4e-=4OH-,总反应式-正极反应式=负极反应式,因此负极反应式为Zn-2e-+3OH-=HZnO2-+H2O;
B、65gZn的物质的量为1mol,根据2Zn+2NaOH+O2=2NaHZnO2计算氧气的物质的量为0.5mol,0.5mol氧气的体积与所处的温度和压强有关,因此体积不一定是11.2L;
C、根据异性相吸,电池在放电过程中阳离子移向正极,阴离子移向负极;
D、根据正极电极反应式O2+2H2O+4e-=4OH-判断.
解答 解:A、总反应的离子方程式为2Zn+2OH-+O2=2HZnO2-,在碱性环境下,正极反应式为:O2+2H2O+4e-=4OH-,总反应式-正极反应式=负极反应式,因此负极反应式为Zn-2e-+3OH-=HZnO2-+H2O,故A正确;
B、65gZn的物质的量为1mol,根据2Zn+2NaOH+O2=2NaHZnO2计算氧气的物质的量为0.5mol,0.5mol氧气的体积与所处的温度和压强有关,因此体积不一定是11.2L,故B错误;
C、根据异性相吸,电池在放电过程中阳离子移向正极,阴离子移向负极,故C错误;
D、该电池的正极反应式O2+2H2O+4e-=4OH-,电池正极区域附近OH-浓度增大,pH减大,故D错误;
故选A.
点评 本题考查了原电池原理,侧重于新型化学电池电极反应式的书写和有关计算,难度中等,书写电极反应式时可根据①负氧化、正还原②总反应式-正极反应式=负极反应式③三个守恒:元素守恒、电子守恒、电荷守恒④电解质溶液的影响分析判断.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 原混合溶液中c(K+)为4 mol•L-1 | |
| B. | 上述电解过程中共转移4 mol电子 | |
| C. | 电解得到的Cu的物质的量为0.5 mol | |
| D. | 电解后溶液中c(H+)为2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 规律 | 结论 |
| A | 沸点高的物质制备沸点低的物质 | 钙置换出铷,或浓磷酸制备HI |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | BCl3沸点低于AlCl3,CO2沸点低于SiO2 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
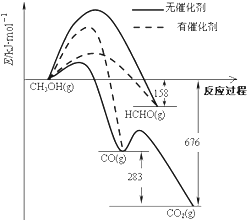 如图所示为一定条件下1molCH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].下列说法不正确的是( )
如图所示为一定条件下1molCH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].下列说法不正确的是( )| A. | 未使用催化剂,氧化产物有三种 | |
| B. | 使用催化剂,氧化产物主要是CO或者HCHO | |
| C. | CH3OH的燃烧热大于676kJ•mol-1 | |
| D. | 2HCHO(g)+O2=2CO(g)+2H2O(g)△H=-470kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp(25℃) | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.0 | ≥6.7 | ≥3.2 |
| A. | 向该混合溶液中逐滴加入NaOH溶液,最先看到白色沉淀 | |
| B. | PH=10时溶液中c(Cu2+):c(Fe2+:c(Fe3+)=(2.2×10-20):(8.0×10-16 ):( 4.0×10-34 ) | |
| C. | 该溶液中2c(SO42-)=2c(Cu2+)+2c(Fe2+)+3c(Fe3+) | |
| D. | 通入氨气将该溶液的PH调节到9后所得沉淀经过过滤、洗涤、干燥、灼烧,可得三种金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶于水 Na2CO3═Na22++CO32- | |
| B. | Al(OH)3酸式电离 Al(OH)3═H++AlO2-+H2O | |
| C. | NaHS溶于水HS-的电离 HS-+H2O?H2S+OH- | |
| D. | NaHCO3在水溶液中电离 NaHCO3═Na++HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8×10-2 mol•L-1 | B. | 1.4×10-5 mol•L-1 | ||
| C. | 2.8×10-5 mol•L-1 | D. | 5.6×10-5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质是Na2O. |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入适量BaCl2 | 有白色沉淀生成 | 白色物质是Na2CO3 |
| ②静置片刻,取上层清液于试管中… | …. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com