
【题目】2015年10月5日,我国女药学家屠哟哟发现青蒿素(分子式为C15H22O5)治疗疟疾。而荣获2015年诺贝尔生理学医学奖。青蒿素的一种化学合成路线部分工艺流程(→……→表示省略了许多步骤)如下:
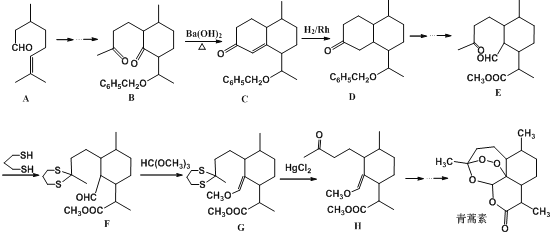
(1)1mol青蒿素完全燃烧消耗O2的物质的量为___________。
(2) A中含氧官能团的名称___________,该物质核磁共振氢谱中一共有___________个吸收峰,C→D的反应类型___________,B→C实际上是分两步反应进行的,先进行加成反应,再进行___________反应。
(3)写出丙酮![]() 与
与![]() 一定条件下反应的化学方程式___________;合成路线中设计由E→F与G→H的目的是___________;
一定条件下反应的化学方程式___________;合成路线中设计由E→F与G→H的目的是___________;
(4)任写一种同时满足以下条件的青蒿素的同分异构体的结构简式___________;
①能与FeC13溶液发生显色反应
②能与NaHCO3溶液反应
③lmol该物质与足量NaOH反应消耗4mo1NaOH
④该物质核磁共振氢谱中有6组吸收峰.且峰面积之比为1:1:2:2:4:12
【答案】
(1)18mol
(2)醛基;8;加成反应;消去反应
(3)![]() ;保护羰基;
;保护羰基;
(4) 或
或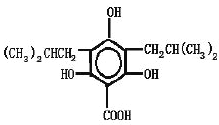
【解析】
试题分析:(1)根据青蒿素的结构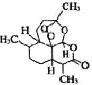 ,分子式为C15H22O5,1mol青蒿素完全燃烧消耗O2的物质的量为15+
,分子式为C15H22O5,1mol青蒿素完全燃烧消耗O2的物质的量为15+![]() -
-![]() =18mol,故答案为:18mol;
=18mol,故答案为:18mol;
(2) A为![]() ,其中含氧官能团是醛基,该物质核磁共振氢谱中一共有8个吸收峰,根据流程图,C和D分子结构上相差了一个碳碳双键,因此C→D的反应类型为加成反应,B→C实际上是分两步反应进行的,先进行加成反应将羰基转变为羟基,再进行消去反应生成碳碳双键,故答案为:醛基;8;加成反应;消去反应;
,其中含氧官能团是醛基,该物质核磁共振氢谱中一共有8个吸收峰,根据流程图,C和D分子结构上相差了一个碳碳双键,因此C→D的反应类型为加成反应,B→C实际上是分两步反应进行的,先进行加成反应将羰基转变为羟基,再进行消去反应生成碳碳双键,故答案为:醛基;8;加成反应;消去反应;
(3)丙酮![]() 与
与![]() 一定条件下反应的化学方程式为
一定条件下反应的化学方程式为![]() ;由E→F的结构可知,羰基中C=O双键变成C-S单键,由G→H的结构可知C-S单键又变成羰基,目的是保护羰基,
;由E→F的结构可知,羰基中C=O双键变成C-S单键,由G→H的结构可知C-S单键又变成羰基,目的是保护羰基,
故答案为:![]() ;保护羰基;
;保护羰基;
(4)①能与FeC13溶液发生显色反应,表示苯上含有羟基;②能与NaHCO3溶液反应,说明含有羧基;③lmol该物质与足量NaOH反应消耗4mo1NaOH④该物质核磁共振氢谱中有6组吸收峰.且峰面积之比为1:1:2:2:4:12。满足上述条件的青蒿素的同分异构体的结构简式有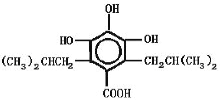 、
、 ,故答案为:
,故答案为: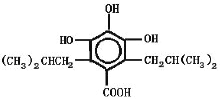 或
或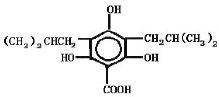 。
。


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】(1)在一定条件下,乙烷和乙烯都能制备氯乙烷(C2H5Cl)。用乙烷制备氯乙烷的化学方程式是:____________,反应类型为__________。用乙烯制备氯乙烷的化学方程式是: 。
(2)乙炔(HC≡CH)也是一种不饱和烃,与乙烯具有相似的化学性质,写出乙炔与足量溴水反应的化学方程式: 。
(3)已知 可表示为
可表示为![]() ,下图是某高聚物的合成路线,试完成下列试题:
,下图是某高聚物的合成路线,试完成下列试题:
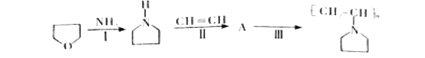
①Ⅱ反应类型 。
②Ⅲ反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取COC2O4·2H2O工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:

(1)浸出过程中加入Na2SO3的目的是_______________。
(2)NaClO3在反应中氯元素被还原为最低价,该反应的离子方程式为 ______________。
(3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀。试用离子方程式和必要的文字简述其原理:_____________________________________。
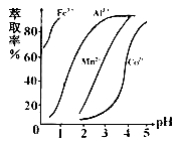
(4)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液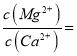 ______。
______。
(5)萃取剂对金属离子的萃取率与pH的关系如右图所示,在滤液II中适宜萃取的pH为___左右。
a.1 b.2 c.3 d.4
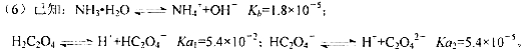
则该流程中所用(NH4)2C2O4溶液的pH_____7(填“>”或“<”或“=”)
(7)CoC2O4·2H2O热分解质量变化过程如右图所示(其中600℃以前是隔绝空气加热,600℃以后是在空气中加热);A、B、C均为纯净物;C点所示产物的化学式是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结晶玫瑰是具有玫瑰香气的香料,可由下列方法合成(部分反应物及反应条件未标出)
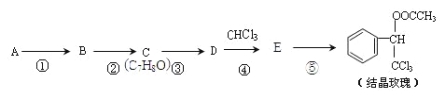
已知: ![]() (-R表示烃基)
(-R表示烃基)
(1)A是苯的一种同系物,相同条件下,其蒸气对氢气的相对密度是46,则A的结构简式是 。
(2)反应①的条件是氯气和光照,则反应②的方程式是 。
(3)D的核磁共振氢谱共有 组峰。
(4)③的化学方程式是 。
(5)C有多种同分异构体,写出其中含苯环且不属于酚类的同分异构体的结构简式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是合成治疗高血压药物奈必洛尔的重要中间体,其部分合成路线图如下(Ph代表苯基):

(1)化合物C的含氧官能团名称为________、________。
(2)B→C的反应类型是________。
(3)写出A→B的化学反应方程式________。
(4)C→D的转化中,反应物G的分子式为C6H10O3,生成物除D外还有Ph3P=O,则G的结构简式为_________
(5)写出同时满足下列条件的B的一种同分异构体的结构简式________。
Ⅰ.分子中含有一个酯基和一个手性碳原子,有4种化学环境不同的氢;
Ⅱ.不能发生银镜反应;
Ⅲ.能发生水解反应,且其中一种水解产物能与FeCl3溶液发生显色反应。
(6)已知:
①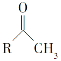
![]() RCOONa
RCOONa
②![]()
![]()
![]()
化合物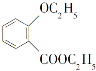 是一种重要的有机合成中间体,请写出以苯酚、乙醇和
是一种重要的有机合成中间体,请写出以苯酚、乙醇和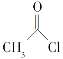 为原料制备该化合物的合成路线流程图(无机试剂作用)。合成路线流程图示例如下:
为原料制备该化合物的合成路线流程图(无机试剂作用)。合成路线流程图示例如下:
H2C===CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物含量显得尤为重要。
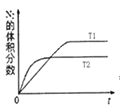
(1)汽车内燃机工作时会引起N2和O2的反应:N2+O2═2NO,是导致汽车尾气中含有NO的原因之一;在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图所示,根据图象判断反应N2(g)+O2(g)═2NO(g)的△H__________ 0(填“>”或“<”)。
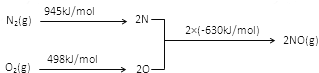
(2)NOx是汽车尾气中的主要污染物之一。汽车发动机工作时会引起N2和O2反应,其能量变化如图所示,写出该反应的热化学方程式_____________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳单质及其化合物有广泛的应用。
(1)碳的同素异性体金刚石、石墨和C60晶体中,能溶于有机溶剂的是___,原因是_______。
(2)CH3COCH=CHCH3分子中,C原子所采取的杂化类型有____________。
(3)石墨晶体由层状石墨“分子”按ABAB方式堆积而成,如图所示,图中用虚线标出了石墨的一个六方晶胞。该晶胞中含有的碳原子数为_____个。

(4)石墨烯是一种由单层碳原子构成的平面结构新型碳材料,如图所示。1mol石墨烯中含有的六元环个数为______,下列有关石墨烯说法正确的是________
a.晶体中碳原子间全部是碳碳单键
b.石墨烯中所有碳原子可以处于同一个平面
c.从石墨中剥离得到石墨烯需克服分子间作用力
(5)石墨烯可转化为C60,C60的结构如图所示,该分子是由五边形和六边形构成的球体,其中五边形有12个,六边形有________个。
(6)金刚石晶胞如图所示,则金刚石晶胞中原子的配位数为_____,原子空间利用率为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平,E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料。
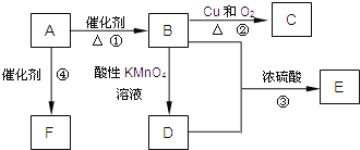
(1)A的结构式为______。
(2)B分子中的官能团名称是______,C的名称为______。
(3)写出下列反应的化学方程式:
①__ ___。
③___ ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是一种性能非常优越的金属,它化学性质稳定,耐腐蚀、钛及钛合金主要用于飞机、火箭、导弹、人造卫星和宇宙飞船等领域,某实验室模拟硫酸法生产二氧化钛,实验流程如下:

(1)酸解过程中发生的主要反应如下:FeTiO3+3H2SO4=Ti(SO4)2+FeSO4+3H2O 请补充生成TiOSO4的化学方程式________________________________________;
(2)若取5g钛铁矿(主要成分是FeTiO3,含少量Fe2O3)于蒸发皿,加适量98%浓硫酸(密度1.84g/cm3)加热,请选择最接近的浓硫酸的用量_____________(填序号)。
A.2mL B.6mL C.25mL D.100mL
(3)在酸解后的浸取过程中,为提高浸出率可采用的方法有_____________。(任答一点)
(4)加“还原铁粉”的目的_____________。
(5)请根据FeSO4溶解度曲线,补充由过虑I中滤液获得副产品绿矾(FeSO4·7H2O)的具体操作:取过滤I所得的滤液_______________________________________________________________。

(6)“水解”过程的操作步骤:将滤液加热至90℃,加6~7倍体积的溺水,保持沸腾60min,减压过滤,用2mol/LH2SO4溶液洗涤沉淀,请思考,“将滤液加热至90℃”作用是_____________________________。沉淀用2mol/LH2SO4溶液洗涤而不是用水洗涤的原因_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com