
如图所示的装置,在盛有水的烧杯中,铁圈和银圈的相接处吊着一根绝缘的细丝,使之平衡。小心地从烧杯中央滴入AgNO3溶液。片刻后可观察到的现象是(指悬吊的金属圈)
 A.铁圈和银圈左右摇摆不定 B.保持平衡状态不变
A.铁圈和银圈左右摇摆不定 B.保持平衡状态不变
C.铁圈向下倾斜 D.银圈向下倾斜
 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
铜有两种常见的氧化物CuO和Cu2O。某学习小组取0.98 g(用精密天平测量)Cu(OH)2固体,将其加热有铜的氧化物生成,其质量随温度变化的曲线如图1所示。

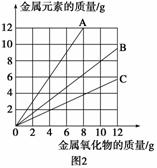
另外,某同学绘制了三条表示金属氧化物与其所含金属元素质量的关系曲线,如图2所示。则下列分析正确的是 ( )
A.图1中产物a、b的化学式分别为Cu2O和CuO
B.图1整个过程中共生成0.26 g H2O
C.图2三条曲线中,表示CuO和其中所含Cu元素质量的关系曲线是曲线A
D.图2中绘制错误的曲线共2条
查看答案和解析>>
科目:高中化学 来源: 题型:
金属钛对人体体液无毒且有惰性,能与肌肉和骨骼生长在一起,有“生物金属”
之称.下列有关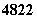 Ti和
Ti和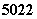 Ti 的说法中正确的是
Ti 的说法中正确的是
A. Ti和
Ti和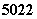 Ti的质量数相同,互称为同位素
Ti的质量数相同,互称为同位素
B.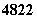 Ti和
Ti和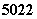 Ti的质子数相同,互称同位素
Ti的质子数相同,互称同位素
C.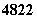 Ti和
Ti和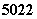 Ti的质子数相同,是同一种核素
Ti的质子数相同,是同一种核素
D.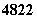 Ti和
Ti和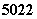 Ti核外电子数相同,中子数不同,不能互称为同位素
Ti核外电子数相同,中子数不同,不能互称为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
物质的量之比为2:5的锌与稀硝酸恰好完全反应,若硝酸被还原的产物为N2O,
反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是
A. 1:4 B.1:5 C. 2:3 D.2:5
查看答案和解析>>
科目:高中化学 来源: 题型:
莽草酸是合成治疗禽流感的药物——达菲(Tamiflu)的原料之一。莽草酸是A的一种异构体。A的结构简式如下:
ഠ
(1)A的分子式是 。
(2)A与溴的四氯化碳溶液反应生成物的结构简式是
(3)A与氢氧化钠溶液反应的化学方程式(有机物用结构简式表示)是
(4)17.4克A与足量碳酸氢钠溶液反应,计算生成二氧化碳的体积 (标准状况)。(5)A在浓硫酸作用下加热可得到B(B的结构简式为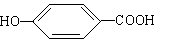 ),其反应类型 。
),其反应类型 。
(6)B的同分异构体中既含有酚羟基又含有酯基的共有 种,写出其中一种同分异构体的结构简式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
第119号未知元素,有人称为“类钫”。根据周期表结构及元素性质变化趋势,有关“类钫”的预测的说法错误的是
A.单质有较高的熔点 B.“类钫”在化合物中呈+1价
C.“类钫”具有放射性 D.“类钫”单质的密度小于1g.cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
强酸和强碱的稀溶液的中和热可表示为:
H+(aq)+OH-(aq)=H2O(1) △H = -57.3kJ/mol
已知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(1) △H =- Q1kJ/mol
1/2 H2SO4(浓) + NaOH(aq) == 1/2Na2SO4(aq) +H2O(1) △H =- Q2kJ/mol
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(1) △H =- Q3kJ/mol
上述反应均为溶液中的反应,则Q1、Q2、Q3的绝对值大小的关系为
A.Q1=Q2=Q3 B.Q2>Q1>Q3 C.Q2>Q3>Q1 D.Q2=Q3>Q1
查看答案和解析>>
科目:高中化学 来源: 题型:
标准状况下,将3.36 L CO2气体通入200 mL 1.00 mol·L-1 NaOH溶液中,充分反应后溶液中c(CO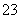 )与 c(HCO
)与 c(HCO )的比值为(不考虑CO
)的比值为(不考虑CO 、HCO
、HCO 的水解) ( )
的水解) ( )
A.1∶1 B.1∶2
C.2∶1 D.1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
用硫酸铁电化浸出黄铜矿精矿工艺中,精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+===Cu2++5Fe2++2S。下列说法正确的是( )
A.反应中硫元素被氧化,所有铁元素均被还原
B.还原剂是S2-和Cu+,氧化剂是Fe3+
C.氧化产物是S,还原产物是Cu2+和Fe2+
D.当转移1 mol e-时,有46 g CuFeS2参加反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com