
| A. | 元素R位于周期表中第ⅤA族 | |
| B. | R只能被还原 | |
| C. | R2在常温常压下一定是气体 | |
| D. | 若1mol RO3-参与该反应,则转移的电子的物质的量为5 mol |
分析 A、由反应方程式可知,R的最低负价为-1,则其最高正价为+7价,族序数等于最高正化合价.
B、R2中R为0价,R的最低负价为-1,R最高正价为+7价,元素处于中间价态既具有氧化性又具有还原性.
C、若R为I或Br也可以发生如上反应.
D、反应中R元素化合价由+5价降低为0,据此计算.
解答 解:A、由反应方程式可知,R的最低负价为-1,则其最高正价为+7价,族序数等于最高正化合价,元素R应位于第ⅦA族,故A错误;
B、R2中R为0价,R的最低负价为-1,R最高正价为+7价,元素处于中间价态既具有氧化性又具有还原性,故B错误;
C、若R为Cl,单质为气体,若R为I或Br也可以发生如上反应,碘为固体,溴为液体,故C错误;
D、反应中R元素化合价由+5价降低为0,若1molRO3-参与该反应,则转移的电子的物质的量为1mol×(5-0)=5mol,故D正确.
故选:D.
点评 本题考查氧化还原反应及元素的位置和性质,正确判断元素是解题的关键.只有注意结合隐含条件,才能正确判断出元素.


科目:高中化学 来源: 题型:解答题
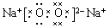 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能 (kJ•mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 不纯物 | 除杂试剂 | 分离方法 |
| A | CH4(C2H4) | 酸性KMn04溶液 | 洗气 |
| B | NH4Cl溶液(FeCl3) | NaOH溶液 | 过滤 |
| C | 福尔马林(甲酸) | Na2CO3溶液 | 蒸馏 |
| D | 苯(苯酚) | 溴 水 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
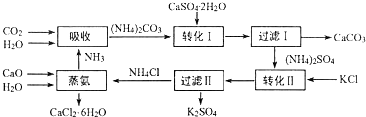
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com