
分析 设出氢氧化钡溶液、盐酸溶液的体积,然后根据溶液的pH列式计算出二者的体积比.
解答 解:设氢氧化钡容溶液的体积为xL,盐酸的体积为y,pH=8的Ba(OH)2溶液,溶液中c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-8}}$=1×10-4mol/L,
pH=5的稀盐酸溶液中c(H+)=1×10-5mol/L,
欲使混合溶液pH=7,溶液此时显碱性,即混合后c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-7}}$mol/L=1×10-5mol/L,则混合后c(OH-)=$\frac{1{0}^{-4}x-1{0}^{-5}y}{x+y}$=1×10-5mol/L,解得x:y=2:9,
答:Ba(OH)2与盐酸的体积比为2:9.
点评 本题考查了水的电离平衡分析、离子积常数的计算应用,题目难度不大,注意离子积是一定温度下的常数,随温度改变,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 硬脂酸甘油酯和乙酸乙酯都属于酯类物质,都能发生皂化反应 | |
| B. | 制造纸张的原料棉花、制造毛皮大衣的原料皮革,它们的主要成分都是纤维素 | |
| C. | 在淀粉水解液中加过量NaOH,滴加碘水,如溶液未显蓝色,则证明淀粉水解完全 | |
| D. | 体积分数75%的乙醇溶液可用于医疗消毒,原理是乙醇使细菌的蛋白质发生变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO的结构式:H-Cl-O | B. | MgO的电子式:Mg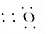 | ||
| C. | 四氯化碳分子比例模型: | D. | 聚四氟乙烯的结构简式: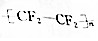 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
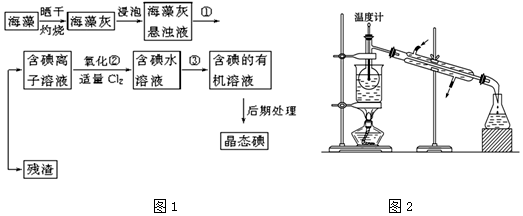
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃,pH=11的Na2CO3溶液中由水电离出的H+的数目为10-3NA | |
| B. | 标准状况下,2.24L NO与11.2L O2混合后气体的分子数小于NA | |
| C. | 120g熔融的NaHSO4中含阳离子总数为2NA | |
| D. | 用5mL 3mol/L FeCl3溶液制成的氢氧化铁胶体中所含胶粒数为0.015NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LC2H5OH含有的氢原子数为3NA | |
| B. | 25℃时,1LpH=12的碳酸钠溶液中含有Na+的数目为0.02NA | |
| C. | 过氧化钠与水反应时,生成0.5molO2转移的电子数为NA | |
| D. | 2molSO2和1molO2在一定条件下充分反应,所得混合气体的分子数等于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
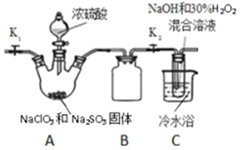 亚氯酸钠(NaClO2)和ClO2都是重要的漂白剂.通常情况下,ClO2是一种具有强氧化性的黄色气体,常用于水的净化和纸浆、纺织品的漂白.ClO2易发生爆炸,在生产、使用时可用其它气体进行稀释.ClO2易与碱反应生成亚氯酸盐和氯酸盐.
亚氯酸钠(NaClO2)和ClO2都是重要的漂白剂.通常情况下,ClO2是一种具有强氧化性的黄色气体,常用于水的净化和纸浆、纺织品的漂白.ClO2易发生爆炸,在生产、使用时可用其它气体进行稀释.ClO2易与碱反应生成亚氯酸盐和氯酸盐.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com