
| A、等物质的量的CH4在反应①、②中转移电子数相同 |
| B、由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l);△H>-574kJ/mol |
| C、4NO2(g)+2N2(g)=8NO(g);△H=+586kJ/mol |
| D、若用标准状况下4.48L CH4把NO2还原为N2,整个过程中转移的电子总数为1.6NA |
| ①+② |
| 2 |


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
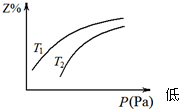 在密闭容器中发生反应:X+3Y═2Z(该反应放热),其中Z呈气态,且Z在平衡混合气中的体积分数(Z%)与温度(T)、压强(P)的关系如图.下列判断正确的是( )
在密闭容器中发生反应:X+3Y═2Z(该反应放热),其中Z呈气态,且Z在平衡混合气中的体积分数(Z%)与温度(T)、压强(P)的关系如图.下列判断正确的是( )| A、T1大于T2 |
| B、Y一定呈气态 |
| C、升高温度,该反应的正反应速率减小 |
| D、当n(X):n(Y):n(Z)=1:3:2时,反应一定达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、微粒半径:F-<Cl-<Br -<I- |
| B、稳定性:HI<HBr<HCl<HF |
| C、沸点:HF<HCl<HBr<HI |
| D、阴离子还原性:F-<Cl -<Br -<I - |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使用太阳能热水器、沼气的利用、玉米制乙醇都涉及到生物质能的利用 |
| B、石油、煤、天然气、可燃冰、植物油都属于化石燃料 |
| C、向汽油中添加甲醇后,该混合燃料的热值不变 |
| D、利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com