
| A. |
| B. |
| C. |
| D. |
|
分析 A、1号和11号中间还有3号元素;
B、4和5,12和13间有10个空列为7个副族和1个Ⅷ族,且与5号同主族相邻的下一周期原子序数为13,与6号同主族相邻的下一周期原子序数为14;
C、10号元素与4号元素处于同一周期;
D、最前列为ⅥA族,最小行为16、17、18,最后列为零族,第一、三周期的原子序数为2、18.
解答 解:A、1号和11号中间还有3号元素,不符合位置关系,故A错误;
B、4和5,12和13间有10个空列为7个副族和1个Ⅷ族,且与5号同主族相邻的下一周期原子序数为13,与6号同主族相邻的下一周期原子序数为14,不符合位置关系,故B错误;
C、10号元素与4号元素处于同一周期,不符合位置关系,故C错误;
D、最前列为ⅥA族,最小行为16、17、18,最后列为零族,第一、三周期的原子序数为2、18,符合位置关系,不符合位置关系,故D正确;
故选D.
点评 本题考查运用原子序数推导元素在周期表中的位置关系,难度中等,关键清楚元素周期表的结构.


科目:高中化学 来源: 题型:解答题
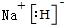 ;RX与X2Q反应的化学方程式为NaH+H2O=NaOH+H2↑.
;RX与X2Q反应的化学方程式为NaH+H2O=NaOH+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (或
(或 、
、 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2、CsCl、CF4、CBr4 | B. | CsCl、SiO2、CBr4、CF4 | ||
| C. | SiO2、CsCl、CBr4、CF4 | D. | CF4、CBr4、CsCl、SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
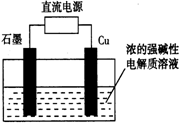 Cu2O可由电解制取,如图所示,电解总反应:2Cu+H2O=Cu2O+H2↑.下列说法正确的是( )
Cu2O可由电解制取,如图所示,电解总反应:2Cu+H2O=Cu2O+H2↑.下列说法正确的是( )| A. | 石墨电极上产生氢气 | B. | 铜电极发生还原反应 | ||
| C. | 铜电极接直流电源的负极 | D. | 该反应也可设计为原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中通入少量的氯气:Cl2+H2O=2H++Cl-+ClO- | |
| B. | Al2(SO4)3中加入过量的氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| C. | 碳酸氢氨溶液和过量NaOH溶液反应:HCO3-+OH-=CO32-+H2O | |
| D. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+Cl2↑+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | 电离常数(25℃) |
| CH3COOH | Ka=1.8×10-5 |
| H2SO3 | Ka1=1.23×10-2 Ka2=6.6×10-8 |
| NH3.H2O | Kb=1.8×10-5 |
| A. | 25℃时,pH=3的醋酸和pH=11的氨水等体积混合后,混合液中水的电离是被促进的 | |
| B. | Na2SO3溶液中滴加足量醋酸,反应的离子方程式为:SO32-+2CH3COOH=SO2↑+H2O+2CH3COO- | |
| C. | NaHSO3溶液呈酸性,是因为Kw/Ka1>Ka2 | |
| D. | 0.1mol/L的CH3COOH溶液与等浓度等体积的CH3COONa混合后,溶液中的微粒存在以下关系:c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向1mL1%的NaOH溶液中加入2mL2%的CuSO4溶液,振荡后再加入0.5mL有机物X,加热后未出现砖红色沉淀,说明X结构中不含有醛基 | |
| B. | 室温下向苯和少量苯酚的混合溶液中加入适量浓溴水,振荡、静置后过滤,可除去苯中少量苯酚 | |
| C. | 向无色的淀粉KI溶液中滴加少量氯水,溶液变成蓝色,说明氧化性:Cl2>I2 | |
| D. | 向含酚酞的氢氧化钠溶液中加入少量30%H2O2溶液,红色褪去,向褪色后的溶液再补加NaOH溶液,不显红色,说明H2O2因显酸性而使溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com