
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ����(����)
A. ��������ˮ��Cl2+H2O2H++Cl��+ClO��
B. ��FeSO4��Һ�м���H2SO4�ữ��KMnO4��Һ��5Fe2++MnO4��+8H+�T5Fe3++Mn2++4H2O
C. ����������ʯ��ˮ�м���������NaHCO3��Һ��Ca2++OH��+HCO3���TCaCO3��+H2O
D. ��ͭ���缫���NaCl��Һ��2Cl��+2H2O![]() H2��+Cl2��+2OH��
H2��+Cl2��+2OH��
���𰸡�B
��������
A��HClO��������ʣ�д��ѧʽ�����ӷ���ʽΪCl2+H2OH++Cl��+HClO����A����
B������������ԭ��Ӧ���������ӡ������Ӻ�ˮ�����ӷ���ʽΪ5Fe2++MnO4��+8H+�T5Fe3++Mn2++4H2O����B��ȷ��
C�����߷�Ӧ����̼��ơ�̼���ƺ�ˮ�����ӷ���ʽΪCa2++2OH��+2HCO3���TCaCO3��+2H2O+CO32������C����
D��������Cuʧ���ӷ���������Ӧ�����ӷ���ʽΪCu+2H2O![]() Cu(OH)2��+H2������D����
Cu(OH)2��+H2������D����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������(NOx)�Ǵ�����Ⱦ��֮һ����ҵ����һ���¶Ⱥʹ�����������NH3��NOx��ԭ����N2��ijͬѧ��ʵ�����ж�NH3��NOx��Ӧ������̽�����ش��������⣺
��1���������Ʊ�

�ٰ����ķ���װ�ÿ���ѡ����ͼ�е�________����Ӧ�Ļ�ѧ����ʽΪ______________��
��Ԥ�ռ�һƿ����İ�����ѡ����ͼ�е�װ�ã�������˳��Ϊ������װ����______(������������Сд��ĸ��ʾ)��
��2����������������ķ�Ӧ�������ռ�����NH3����ע����X�У�Ӳ�ʲ�����Y�м�����������������NO2(�����ü���K1��K2�к�)����һ���¶��°�ͼʾװ�ý���ʵ�顣

�������� | ʵ������ | ����ԭ�� |
��K1���ƶ�ע����������ʹX�е����建��ͨ��Y���� | ��Y����_____________ | �ڷ�Ӧ�Ļ�ѧ����ʽ ____________ |
��ע���������˻�ԭ�����̶�����װ�ûָ������� | Y����������ˮ�� | ���ɵ���̬ˮ���� |
��K2 | ��_______________ | ��______________ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(Ga)����( Ge)����(As)����(Se)��Ϊ�������ڵ�Ԫ�أ������ڸ߿Ƽ���˿�ѧ�ر�����Ϣ�������Ź㷺����;���Իش��������⣺
��1����̬��ԭ�ӵļ۵����Ų�ͼΪ_____��
��2���е㣺NH3_______AsH3������������������������������ԭ����____________��
��3��H2SeO4��H2SeO3���������ֺ�����,����ݽṹ�����ʵĹ�ϵ������H2SeO4��H2SeO3 ����ǿ��ԭ��________��
��4���黯�ؿ���(CH3)3Ga��AsH3��700���·�Ӧ�Ƶã�ͬʱ�õ�һ������л��д���÷�Ӧ�ķ���ʽΪ_____���黯�صľ����ṹ����ͼ��ʾ���侧���߳�Ϊa pm��1pm=10-12m������ÿ�������þ�����������Ԫ�ص�����Ϊ_____g����NA��ʾ�����ӵ�������ֵ����
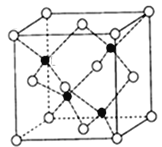
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2017��5��18�գ��й����Ϻ��ɹ��Բɿ�ȼ���������ƶ�������Դ���ø�ֵĸı䣮��ȼ�����ڸ�ѹ���»��������£�ˮ��������װ�м�����Ӷ��ɵ�������������ֱ�ӵ�ȼ����֪ij�ֿ�ȼ���Ļ�ѧʽΪ��CH48H2O����ش�
(1)���ֿ�ȼ���к���_____��Ԫ�أ�ԭ�Ӹ����ȣ�C��H��O=_____��
(2)���ֿ�ȼ���м������������Ϊ_____%��936g��Լ1�����ÿ�ȼ�������¿��ͷų�_____�����飨�����¼����ܶ�Ϊ0.72g/L����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�ΪԪ�����ڱ���һ���֣��û�ѧ����ش��������⣺
���� ���� | I | II | III | IV | V | VI | VII |
һ | �� | ||||||
�� | �� | �� | �� | ||||
�� | �� | �� | �� | �� | �� | �� |
(1)���ԭ�ӽṹʾ��ͼΪ________________��
(2)�ܺ͢������ڱ��е�λ�÷ֱ���________________��________________��
(3)�ں͢���̬�⻯���ȶ��ԵĴ�С˳��________________(�ѧʽ)��
(4)�ۢ�����ۺ������������ǿ����________________(�ѧʽ)��
(5)�۵���̬�⻯����۵�����������Ӧ��ˮ���ﷴӦ���ɵ�����__(�ѧʽ)������___(�������ۻ��������������ӻ�������)��
(6)�٢ܢ�����Ԫ�ص�ԭ�����γ�ԭ����Ŀ��Ϊ1��1��1�Ĺ��ۻ�������ĵ���ʽΪ_____��
(7)���ȽϢܺ͢�����Ԫ�صķǽ�����ǿ����������Ϊ��֤��֤����_____(����ĸ)��
A���Ƚ�������Ԫ�ص��ʵķе�
B���Ƚ�������Ԫ�ص������������ϵ���
C���Ƚ�������Ԫ�ص�����������Ӧˮ����������
D���Ƚ�������Ԫ�ص��������Ӧ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ�����ӵ�������ֵ������Ϊ�������������ƹ㷺Ӧ����ұ��Ⱦ�ϡ�Ƥ���Ƶȹ�ҵ�����Ƶ�һ���Ʊ�������Na2SO4+2C![]() Na2S+2CO2���������й�˵����ȷ����
Na2S+2CO2���������й�˵����ȷ����
A. 1mol/LNa2SO4��Һ�к���ԭ�ӵ���Ŀһ������4NA
B. 1L0.1mol/LNa2S��Һ�к������ӵ���ĿС��0.1NA
C. ����1mol��������ʱת�Ƶ�����Ϊ4NA
D. ͨ��״����11.2LCO2�к����ӵ���ĿΪ11NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(NOCl���۵㣺-64.5�棬�е㣺-5.5��)��һ�ֻ�ɫ���壬��ˮ��ˮ�⡣�����ںϳ���������ý�����м���ȡ�ʵ���ҿ���������һ�������ڳ��³�ѹ�ºϳɡ�
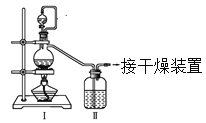
(1)�����ͬѧ���Ʊ�ԭ����NO��Cl2���Ʊ�װ������ͼ��ʾ��
Ϊ�Ʊ�������������壬�±���ȱ�ٵ�ҩƷ�ǣ�
װ�â� | װ�â� | ||
��ƿ�� | ��Һ©���� | ||
�Ʊ�����Cl2 | MnO2 | ��________ | ��________ |
�Ʊ�����NO | Cu | ��________ | ��________ |
(2)����ͬѧ���ü����Ƶõ�NO��Cl2�Ʊ�NOCl��װ����ͼ��ʾ��
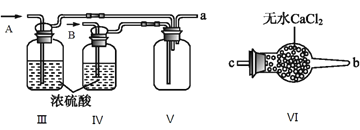
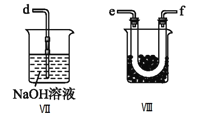
��Ϊ��ʹ�����ַ�Ӧ����A�������������____________(��Cl2��NO)��
��װ������˳��Ϊa��_______________________(�������������ҷ�����Сд��ĸ��ʾ)��
��װ�����������ɸ���NO��Cl2�⣬��һ��������________________________��
��װ�â����ձ���ʢ�ŵ��Լ���_____________________(������ˮ����ˮ������ˮ)
��װ�â�������β��ʱ��NOCl������Ӧ�Ļ�ѧ����ʽΪ___________________________________��
(3)����ͬѧ���������������ˮ��Ũ������Ũ����Ļ�����һ�������»���������������Ⱥ��������÷�Ӧ�Ļ�ѧ����ʽΪ________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ��Һ�п��ܺ���H+��Na+��NH4+��Mg2+��Fe3+��Al3+��SO42-�������еļ��֣��������Һ�м���ijŨ�ȵ�NaOH��Һʱ���������ɳ��������ʵ�����NaOH��Һ������仯��ͼ��ʾ������˵��һ����ȷ����( )
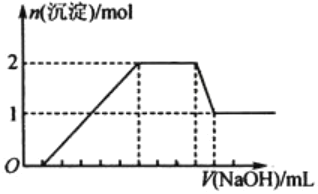
A.һ������H+��Mg2+��Al3+��NH4+��һ��������Na+��SO42-��Fe3+
B.һ������H+��Al3+��NH4+��SO42-�����ܴ���Na+��Mg2+
C.��Һ��c(H+)��c(Al3+)��c(Mg2+)=1��1��2
D.��Һ��![]()
![]()
![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ͼ���Ǻ�ѹ�ܱ�������ͼ���Ǻ����ܱ�������������������ͬʱ���ڢ��зֱ����2molX��2molY����ʼʱ�����������ΪVL���������·�Ӧ���ﵽƽ��״̬����ʾ������X��Y��״̬��δ֪������Z��״̬Ϊ��̬����2X������+Y������aZ��g����ʱ����X��Y��Z�����ʵ���֮��Ϊ1��3��2�������ж���ȷ���ǣ� ��
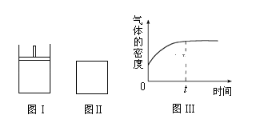
A.����Z�Ļ�ѧ������a=2
B.������������ܶ���ͼ����ʾ����X��Y��ֻ��һ��Ϊ��̬
C.��X��Y��Ϊ��̬������ƽ��ʱX��ת���ʣ���<��
D.��XΪ��̬��YΪ��̬������дӿ�ʼ��ƽ�������ʱ�䣺��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com