
NAΪ�����ӵ����������и��������У���ȷ����
��0.2 mol H2O2��ȫ�ֽ�ת�Ƶĵ�����Ϊ0.4NA
��25 �桢101 kPa�£�16 g O3��O2��������к��е���ԭ����ΪNA
��0.1 mol FeCl3�����ˮ�γɵĽ������ӵ���ĿΪ0.1 NA
��1 mol N2��3 mol H2��һ�������µ��ܱ������г�ַ�Ӧ�������ڵķ���������2NA
| A���٢ڢ� | B���٢ڢ� | C���٢ڢۢ� | D���ڢ� |
D
��������������ٷֽⷴӦΪ��2H2O2 = 2H2O + O2��H2O2����Ԫ�ػ��ϼ�Ϊ�C1�ۣ���ÿĦ��H2O2�ֽ�ʱת��1mol���ӣ�0. 2 mol H2O2�ֽ�ת�Ƶĵ�����ӦΪ0.2NA������ ������ԭ����ΪNA����ȷ���۽����������ɸ������������Ӿۼ���һ���γɵģ�Fe3+ˮ��Ҳ�Dz���ȫ�ģ�����0.1mol FeCl3�����ˮ�γɵĽ�����������0.1NA������N2��H2�ķ�ӦΪ���淴Ӧ��1 mol N2��3 mol H2���ܱ������в�����ȫת��ΪNH3������������������ʵ�������2mol��������������2NA����ȷ����ѡD��
������ԭ����ΪNA����ȷ���۽����������ɸ������������Ӿۼ���һ���γɵģ�Fe3+ˮ��Ҳ�Dz���ȫ�ģ�����0.1mol FeCl3�����ˮ�γɵĽ�����������0.1NA������N2��H2�ķ�ӦΪ���淴Ӧ��1 mol N2��3 mol H2���ܱ������в�����ȫת��ΪNH3������������������ʵ�������2mol��������������2NA����ȷ����ѡD��
���㣺���鰢���ӵ�������


 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����˵����ȷ���ǣ�����NA��ʾ����٤���������� ��
| A�����³�ѹ�£�0.1mol 2H216O�к�������������������������ΪNA |
| B���Ȼƽ��18O2����ͨ��16O2�����ֲ�ͬ�ĺ��� |
| C����״���£�2.24LCl2����ˮ��ת�Ƶĵ�����ĿΪ0.1NA |
| D��1L2mol��L-1��Al(NO3)3��Һ�к�Al3+����Ϊ2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
������������ȷ���ǣ� ��
A���õ���ʽ��ʾHCl���γɹ��̣�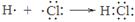 |
B��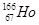 �е�ԭ�Ӻ��ڵ�����������������֮����99 �е�ԭ�Ӻ��ڵ�����������������֮����99 |
C���ڿ����м��Ƚ���ﮣ�4Li + O2 2Li2O 2Li2O |
D�����ȷ�������2Al + Fe2O3 2Fe+ Al2O3 2Fe+ Al2O3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��NA��ʾ�����ӵ�������ֵ������˵����ȷ����( )
| A��0.1mol�İ���(P4)������������Ĺ��ۼ�����Ϊ0.4NA |
| B��l L 0.1mol��L-1��H2SO3��Һ�к���H+����ĿΪ0.2NA |
| C��100mL 3 mol��L-1������11.2g Fe��ַ�Ӧת��0.2NA������ |
| D���ڱ�״���£�22.4 L������Լ����NA��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����йذ���٤������˵����ȷ����
| A����0.2mol H2SO4��Ũ����������п��Ӧ����������ķ�����С��0.1NA |
| B������£�22.4L���Ȼ�̼��������������NA |
| C��0.1mol/L ��AgNO3��Һ�У������������������ĿΪ0.1NA |
| D�����267g����AlCl3��������3mol Cl2��54g������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
������ء���������������ɵĻ����Һ����c(H��)��0.1 mol��L��1��c(Al3��)��0.4 mol��L��1��c(SO42-)��0��8 mol��L��1����c(K��)Ϊ
| A��0.15 mol��L��1 | B��0.2 mol��L��1 | C��0.3 mol��L��1 | D��0.4 mol��L��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����ͬ״���µ�12C18O��14N2�������壬����˵����ȷ���ǣ� ��
| A����������ȣ������������ | B����ԭ������ȣ������������ |
| C������������ȣ��������� | D���������ȣ����ܶ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
NA���������ӵ�����������˵����ȷ����
| A�����³�ѹ�£�11.2 L����������ԭ����ĿΪNA |
| B��NA��������Ӻ�1mol������������ |
| C��2 L 1 mol��L��1�������������Ȼ��������ԼΪ2NA |
| D�������£�0.05 mol CO��SO2���������������ԭ����Ϊ0.1NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����������ͬ���ܱ������зֱ����NH3��CO2��O2�������壬�����ǵ��¶Ⱥ��ܶȶ���ͬʱ�������������ѹǿ��p���Ӵ�С��˳����
| A��p(NH3)>p(CO2)>p(O2) | B��p(NH3)> p(O2)> p(CO2) |
| C��p(CO2)> p(O2)> p(NH3) | D��p(CO2)> p(NH3)> p(O2) |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com