
【题目】由石油分馏得到的轻质油可在Pt催化下脱氢环化,逐步转化为芳香烃。以链烃A为原料合成两种高分子材料的路线如下图所示:

已知以下信息:
①B的核磁共振氢谱中只有1组峰,G为一氯代烃;
② R-X+Rˊ-X ![]() R- Rˊ(X代表卤素原子,R、Rˊ代表烃基)。
R- Rˊ(X代表卤素原子,R、Rˊ代表烃基)。
请回答以下问题:
(1) B的化学名称为______________________。
(2)由G生成H的化学方程式为_____________________。
(3) J的结构简式为_________________。
(4)由F合成丁苯橡胶的化学方程式为________________________。
(5)Ⅰ的同分异构体中能同时满足下列条件的共有____________种(不含立体异构)。
①能与饱和NaHCO3溶液反应产生气体;
②既能发生银镜反应,又能发生水解反应。
其中核磁共振氢谱中有4组峰,且峰面积之比为6:2:1:1的是_________________(写出其中一种的结构简式)。
(6)参照上述合成路线,以2-甲基己烷和一氯甲烷为原料(无机试剂任选),设计制备化合物E的合成路线____________。
【答案】 )环己烷 ![]()
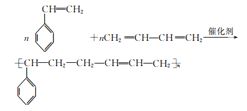 12
12 
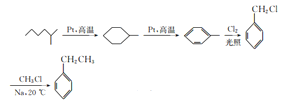
【解析】由已知,由石油分馏得到的轻质油可在Pt催化下脱氢环化,逐步转化为芳香烃,结合流程,链烃A经催化脱氢后得到C6H12,符合烯烃或环烷烃的通式,又因为B的核磁共振氢谱中只有1组峰,所以B为环己烷,B(环己烷)脱氢后,形成C分子式为C6H6,则C为苯;由C→D的反应条件可得,苯在FeCl3催化下与Cl2发生取代反应,生成D(氯苯);由已知信息②可得,氯苯与氯乙烷在钠催化下反应生成E(乙苯);由E和F的分子式可推出,E(乙苯)经催化脱氢生成F(苯乙烯);F(苯乙烯)与1,3-丁二烯发生加聚反应生成丁苯橡胶。B(环己烷)与氯气在光照下发生取代反应,生成G,由已知G为一氯代烃,则G为氯代环己烷(![]() ),G与NaOH的醇溶液发生消去反应,生成H为环己烯,环己烯经氧化生成I(己二酸),己二酸与乙二醇发生缩聚反应生成J(聚酯纤维)。
),G与NaOH的醇溶液发生消去反应,生成H为环己烯,环己烯经氧化生成I(己二酸),己二酸与乙二醇发生缩聚反应生成J(聚酯纤维)。
(1)由上述分析知,B为环己烷。
(2)G为氯代环己烷(![]() ),G与NaOH的醇溶液发生消去反应,生成H为环己烯,化学方程式为:
),G与NaOH的醇溶液发生消去反应,生成H为环己烯,化学方程式为:![]() 。
。
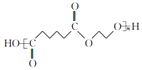
(3)己二酸与乙二醇发生缩聚反应生成J(聚酯纤维),结构简式为: 。
。
(4)F(苯乙烯)与1,3-丁二烯发生加聚反应生成丁苯橡胶,故化学方程式为:n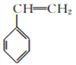 +nCH2=CH-CH=CH2
+nCH2=CH-CH=CH2![]()
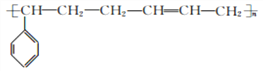 。
。
(5)Ⅰ为己二酸,其同分异构体:①能与饱和NaHCO3溶液反应产生气体,说明分子中含有羧基;②既能发生银镜反应,又能发生水解反应,说明分子中含有醛基和酯基,因为分子中只有4个氧原子,则该物质为甲酸酯。其同分异构体可以看做是丁烷的二取代物,取代基为-COOH和HCOO-,当为正丁烷时,其二取代物有8种,如图所示:![]() 和
和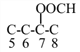 ,当为异丁烷时,其二取代物有4种,如图所示:
,当为异丁烷时,其二取代物有4种,如图所示: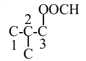 和
和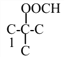 ,所以共12种;其中核磁共振氢谱为4组峰,且面积比为6∶2∶1∶1的是
,所以共12种;其中核磁共振氢谱为4组峰,且面积比为6∶2∶1∶1的是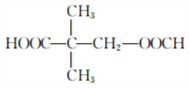 或
或 。
。
(6)E为乙苯,由流程中催化脱氢成环反应得到启发,以2-甲基己烷和一氯甲烷为原料制备乙苯,2-甲基己烷先催化脱氢生成甲基环己烷,再催化脱氢形成甲苯,甲苯与氯气光照下发生甲基上的取代反应,生成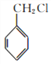 ,
, 与一氯甲烷(CH3Cl)在钠催化下反应生成乙苯,故合成路线为:
与一氯甲烷(CH3Cl)在钠催化下反应生成乙苯,故合成路线为: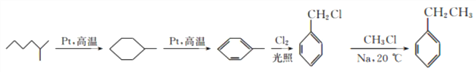 。
。


科目:高中化学 来源: 题型:
【题目】分析城市空气样本,主要污染物为可吸入颗粒物pm2.5、NOx、SO2等,其主要来源为燃煤和机动车尾气排放等。
(1) 某同学为检测样本中所含成份,将样本用蒸馏水处理制成待测试样,设计实验及实验现象如下:
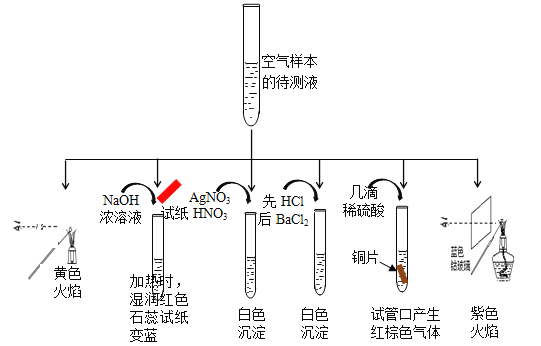
①该实验能确认存在的阳离子是 。
②该实验检测出样本中有NO3-,根据是(用化学方程式解释) 。
③根据该实验能否确定样本中含有SO32-, (填“能”或“否”) ,若要确定SO32-,所需的实验药品可以是 。
(2)PM2.5是指大气中直径小于或等于2.5μm(1μm =103 nm)的颗粒物。下列说法不正确的是 (填字母序号)。
a.PM2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM2.5颗粒小,所以对人体无害
c.直径介于1 ~2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(3)科研工作者用五年时间研究出利用石灰乳除工业燃煤尾气中的硫(SO2、SO3)和氮(NO、NO2)的新工艺,既能净化尾气,又能获得应用广泛的CaSO4和Ca(NO2)2。
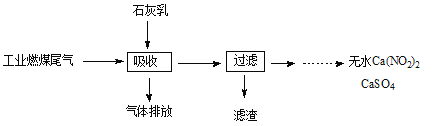
①CaSO4可以调节水泥的硬化时间。尾气中SO2与石灰乳反应生成CaSO4的化学方程式为 。
②Ca(NO2)2可制成混凝土防冻剂、钢筋阻锈剂等。尾气中NO、NO2与石灰乳反应生成Ca(NO2)2的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用铝箔制备Al2O3、AlCl3·6H2O及明矾大晶体,具体流程如下:
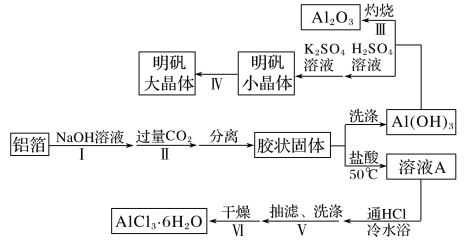
已知:AlCl3·6H2O易溶于水、乙醇及乙醚;明矾在水中的溶解度如下表。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 |
溶解度/g | 3.00 | 3.99 | 5.90 | 8.39 | 11.7 | 24.8 | 71.0 | 109 |
请回答:
(1)步骤Ⅰ中的化学方程式_________;步骤Ⅱ中生成Al(OH)3的离子方程式___________。
(2)步骤Ⅲ,下列操作合理的是____________。
A.坩埚洗净后,无需擦干,即可加入Al(OH)3灼烧
B.为了得到纯Al2O3,需灼烧至恒重
C.若用坩埚钳移动灼热的坩埚,需预热坩埚钳
D.坩埚取下后放在石棉网上冷却待用
E.为确保称量准确,灼烧后应趁热称重
(3)步骤Ⅳ,选出在培养规则明矾大晶体过程中合理的操作并排序_______________。
①迅速降至室温 ②用玻璃棒摩擦器壁 ③配制90℃的明矾饱和溶液 ④自然冷却至室温 ⑤选规则明矾小晶体并悬挂在溶液中央 ⑥配制高于室温10-20℃的明矾饱和溶液
(4)由溶液A制备AlCl3·6H2O的装置如下图:
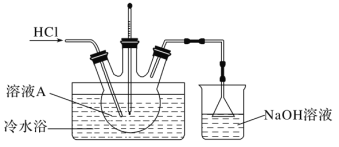
①通入HCl的作用是抑制AlCl3水解和________________________。
②步骤Ⅴ,抽滤时,用玻璃纤维替代滤纸的理由是_____;洗涤时,合适的洗涤剂是_____。
③步骤Ⅵ,为得到纯净的AlCl3·6H2O,宜采用的干燥方式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置做NaHCO3的分解实验,请回答下列问题:
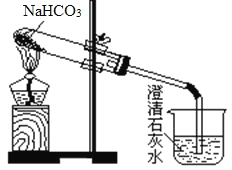
(1)试管中发生反应的化学方程式为_______。
(2)烧杯中可观察到的现象是_______。
(3)组装装置后主要实验操作有:①用酒精灯加热;②熄灭酒精灯;③检查装置的气密性;④在试管里加入NaHCO3固体;⑤将导气管撤离石灰水。则正确的操作为③→_______→_______→_______→②(填各步操作的序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮用水中含有砷会导致砷中毒,水体中溶解的砷主要以As( Ⅲ)亚砷酸盐和As(V)砷酸盐形式存在。
(1)砷与磷为同一主族元素,磷的原子结构示意图为___________________。
(2)根据元素周期律,下列说法正确的是____________________(填字母代号)。
a.最高价氧化物对应水化物的酸性:S>P>As b. 原子半径:S>P>As c.非金属性:S>P>As
(3)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成SO42-,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为_________________________。
(4)去除水体中的砷,可先将As(Ⅲ )转化为As(V),选用NaClO可实现该转化。
已知:投料前水样pH=5.81,0.1 mol/L NaClO溶液pH=10.5,溶液中起氧化作用的物质是次氯酸。
研究NaClO投加量对As(Ⅲ)氧化率的影响得到如下结果:
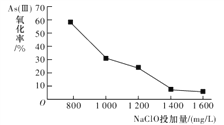
产生此结果的原因是_________________________。
(5)强阴离子交换柱可以吸附以阴离子形式存在的As(V),从而达到去除As的目的。
已知:一定条件下,As(V)的存在形式如下表所示:
pH | <2 | 2~7 | 7~11 | 11~14 |
存在形式 | H3AsO4 | H2AsO4- | HAsO42- | HAsO42-、AsO43- |
pH=6时,NaClO氧化亚砷酸(H3AsO3)的离子方程式是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红热的铁能与水蒸气反应,有氢气生成,现用如图所示装置进行铁在高温下与水蒸气反应的实验,并用简单的方法收集、检验生成的氢气。请回答下列问题:
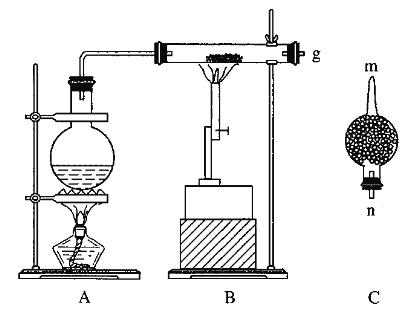
(1)写出铁在高温下与水蒸气反应的化学方程式:____________________________。
(2)干燥管C中盛放的是碱石灰,其作用是___________________。
(3)把B中反应后的产物加入足量的盐酸,用该溶液制取FeCl3·6H2O晶体。
①欲检验溶液中含有Fe3+,选用的试剂为____________,现象是______________________。
②该实验小组同学用上述试剂没有检测到Fe3+,用离子方程式解释滤液中不存在Fe3+可能的的原因:_________________。
③将此滤液中FeCl2完全氧化为FeCl3最好选择下列物质中的_______。
A.酸性KMnO4溶液 B.Cl2 C.Na2O2 D.FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应离子方程式正确的是
A. Na2CO3溶液呈碱性: CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B. NaHCO3溶液中加过量Ca(OH)2溶液:Ca2++ 2OH-+ 2HCO3-=CaCO3↓+CO32-+ 2H2O
C. 漂白粉溶液中通入足量二氧化硫气体:ClO-+ SO2+H2O=HC1O+HSO3-
D. 向NaAlO2溶液中通入过量CO2:AlO2-+ CO2+2H2O=Al(OH)3↓+HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了将混有Na2SO4、NH4HCO3的NaCl提纯。某学习小组设计了如图所示的方案:
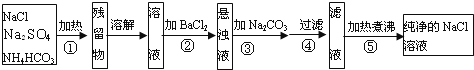
(1)操作①盛放药品的仪器名称是___________,发生反应的化学反应方程式为__________________。
(2)进行操作②后,如何判断杂质是否除尽?_______________________________________________。
(3)操作③的目的是_____________________。
(4)请你评价该设计方案设计是否严密?若不严密,请说明理由,并提出改进方案_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试剂瓶上贴有如下标签,对该试剂理解正确的是
![]()
A. 该溶液中含有的微粒主要有:NaCl、Na+、Cl-、H2O
B. 若取50毫升溶液,其中的c(Cl-)=0.05 mol/L
C. 若取该溶液与0.1 mol/L AgNO3 100 mL溶液完全反应,需要取该溶液10 mL
D. 该溶液与1.0mol/LNa2SO4溶液的c(Na+)相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com