
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是( )
|
| A. | 正极反应式:Ag+Cl﹣﹣e﹣=AgCl |
|
| B. | 每生成1mol Na2Mn5O10转移2mol电子 |
|
| C. | Na+不断向“水”电池的负极移动 |
|
| D. | AgCl是还原产物 |
| 电极反应和电池反应方程式;原电池和电解池的工作原理. | |
| 专题: | 压轴题. |
| 分析: | 根据电池总反应可判断出反应中Ag的化合价升高,被氧化,Ag应为原电池的负极,AgCl是氧化产物;方程式中5MnO2生成1Na2Mn5O10,化合价共降低了2价,所以每生成1molNa2Mn5O10转移2mol电子;在原电池中阴离子向负极移动,阳离子向正极移动,以形成闭合电路. |
| 解答: | 解:A、根据电池总反应:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,可判断出Ag应为原电池的负极,负极发生反应的电极方程式为:Ag+Cl﹣﹣e﹣=AgCl,而不是正极方程式,故A错; B、根据方程式中5MnO2生成1Na2Mn5O10,化合价共降低了2价,所以每生成1molNa2Mn5O10转移2mol电子,故B正确; C、在原电池中阴离子向负极移动,阳离子向正极移动,故C错; D、反应中Ag的化合价升高,被氧化,Ag应为原电池的负极,AgCl是氧化产物,故D错. 故选:B. |
| 点评: | 本题考查原电池的电极反应和离子的定向移动以及电化学的简单计算,做题时要注意总电池反应式的判断利用,运用两极上的反应特点做题,分析Mn元素的化合价变化是该题的难点. |


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
已知空气-锌电池的电极反应:锌片:Zn-2OH--2e- = ZnO + H2O,
石墨:1/2 O2+H2O +2e- = 2OH-,据次推断锌片是
A.负极,被氧化 B.负极,被还原 C.正极,被氧化 D.正极,被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
部分中学化学常见元素原子结构及性质如表所示:
| 序号 | 元素 | 结构及性质 |
| A | A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5 | |
| B | B原子最外层电子数是内层电子总数的1/5 | |
| ③ | C | C是常见化肥的主要元素,单质常温下呈气态 |
| ④ | D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
| ① | E | 通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物 |
| ② | F | F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族 |
23.A元素在周期表中的位置为____________________________________________。
24.B与C形成的化合物的化学式为________,它属于________(填“离子”或“共价”)化合物。
25.①F与E可以形成原子个数比分别为2∶1、1∶1的两种化合物X和Y,区别X与Y的水溶液的实验方法是___________________________________________________
________________________________________________________________________。
②F与C组成的两种化合物M和N所含的电子数分别与X、Y相等,则M的水溶液显________性,N的结构式为________。
26.C与E都是较活泼的非金属元素,用化学方程式表明这两种单质的氧化性强弱
________________________________________________________________________。
27.有人认为B、D的单质用导线连接后插入氯化钠溶液中可以形成原电池,你认为是否可以,若可以,试写出正极的电极方程式(若认为不行可不写)___________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制备BaCl2的工艺流程图如下:
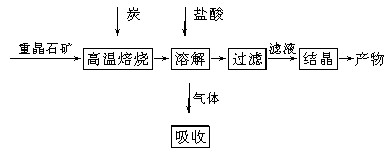
某研究小组在实验室用重晶石(主要成分为BaSO4)对工业过程进行模拟实验。查表得:
BaSO4(s)+4C(s)
 4CO(g)+BaS(s)
4CO(g)+BaS(s)
ΔH1=571.2 kJ·mol-1 ①
BaSO4(s)+2C(s)
 2CO2(g)+BaS(s)
2CO2(g)+BaS(s)
ΔH2=226.2 kJ·mol-1 ②
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为________________________________________________________________________
________________________________________________________________________。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, =__________________。
=__________________。
[Ksp(AgBr)=5.4×10-13 mol2·L-2,Ksp(AgCl)=2.0×10-10 mol2·L-2]
(3)反应:C(s)+CO2(g)
 2CO(g)的ΔH=________kJ·mol-1。
2CO(g)的ΔH=________kJ·mol-1。
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是
________________________________________________________________________,
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于下列各装置图的叙述中,不正确的是( )

|
| A. | 用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 |
|
| B. | 用图②装置实验室制备白色Fe(OH)2 |
|
| C. | 装置③中钢闸门应与外接电源的正极相连 |
|
| D. | 装置④中电子由Zn流向Fe,Zn极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示装置,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近溶液呈红色.请回答:
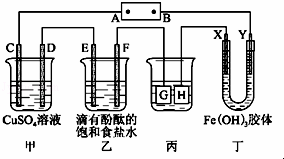
(1)B极是电源的 极.C电极上的电极反应式: .
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 .
(3)现用丙装置给铜件镀银,则H应该是 (填“镀层金属”或“镀件”),电镀液是 溶液.当乙中溶液的pH=13时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为 .
(4)丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明 ,在电场作用下向Y极移动.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是( )
A.向FeCl2溶液中通入Cl2:Fe2++Cl2===Fe3++2Cl-
B.澄清石灰水与少量的小苏打溶液混合:Ca2++OH-+HCO ===CaCO3↓+H2O
===CaCO3↓+H2O
C.FeS固体放入稀硝酸溶液中:FeS+2H+===Fe2++H2S↑
D.AlCl3溶液中加过量氨水:Al3++4OH-===[Al(OH)4]-
查看答案和解析>>
科目:高中化学 来源: 题型:
为了探索外界条件对反应aX(g)+bY(g) cZ(g)的影响,以X和Y物质的量之比为a∶b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示。
cZ(g)的影响,以X和Y物质的量之比为a∶b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示。
下列判断正确的是
A.ΔH>0 a+b>c B.ΔH<0 a+b<c
C.ΔH<0 a+b>c D.ΔH>0 a+b<c

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com