

| 时间/浓度 | c(NH3)(mol/L) | C(O2)(mol/L) | C(NO)(mol/L) |
| 起始 | 0.8 | 1.5 | 0 |
| 第2min | 0.7 | a | 0.1 |
| 第4min | 0.4 | 1.0 | 0.4 |
| 第6min | 0.4 | 1.0 | 0.4 |
| 第8min | 1.2 | 2.5 | 0.4 |
| 0.7-0.4 |
| 4-2 |
| 5 |
| 4 |
| 5 |
| 4 |


科目:高中化学 来源: 题型:
 室温下,单质A、B、C分别为银白色固体、黄绿色气体、无色气体,且A在空气中燃烧会变成淡黄色粉末.在合适的反应条件下,它们可以按下面框图进行反应,且E溶液是无色的.请据图回答:
室温下,单质A、B、C分别为银白色固体、黄绿色气体、无色气体,且A在空气中燃烧会变成淡黄色粉末.在合适的反应条件下,它们可以按下面框图进行反应,且E溶液是无色的.请据图回答:查看答案和解析>>
科目:高中化学 来源: 题型:
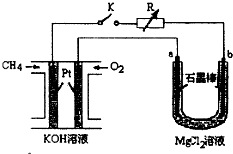 新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入 CH4和 O2,电解质为 KOH 溶液.某研究小组将甲烷燃料电 池作为电源进行氯化镁溶液龟解实验,电解装置如图所示.
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入 CH4和 O2,电解质为 KOH 溶液.某研究小组将甲烷燃料电 池作为电源进行氯化镁溶液龟解实验,电解装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、自来水生产中应尽量用明矾净化、消毒 |
| B、高纯硅及其氧化物在太阳能电池及信息高速传输中有重要应用 |
| C、PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,也称细颗粒物,这些细颗粒物分散在空气中形成混合物具有丁达尔效应 |
| D、绿色化学的核心是利用化学反应原理治理环境污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、节省化石燃料 |
| B、减少有害气体的排放 |
| C、有利于转化过剩的粮食 |
| D、提高每千克燃料燃烧放出的热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com