
【题目】已知A、B为单质,C为化合物,能实现上述转化关系的是( )
![]()
①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液遇Na2CO3放出CO2气体,则A可能是H2
③若C溶液中滴加KSCN溶液显红色,则B可能为Fe
④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
A.①② B.①③
C.②④ D.③④
【答案】
【解析】选C。①若A是Na,B是O2,则C是Na2O2,C的水溶液是NaOH,电解NaOH溶液得到氢气和氧气,错误;②若C溶液遇Na2CO3放出CO2气体,则C可能是HCl、HBr、HI等,电解HCl、HBr、HI等的水溶液就是电解电解质本身,在阴极产生氢气,在阳极产生Cl2、Br2、I2,因此A可能是H2,正确;③若C溶液中滴加KSCN溶液显红色,则C中含有Fe3+,电解铁盐不可能产生金属Fe,错误;④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则C中含有Cu2+,该盐可能是CuCl2、CuBr2溶液,电解CuCl2、CuBr2溶液会产生Cu和Cl2、Br2,因此B可能为Cu ,正确。


科目:高中化学 来源: 题型:
【题目】不同固态物质分子1 mol,体积大小并不相同,主要原因是( )
A. 微粒大小不同 B. 微粒质量不同 C. 微粒间平均距离不同 D. 微粒间引力不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiO2在工业生产和日常生活中有重要用途。
工业上用钛铁矿(主要成分是TiO2、少量FeO和Fe2O3)制备TiO2,再用TiO2制备TiCl4等产品的一种工艺流程如图所示:
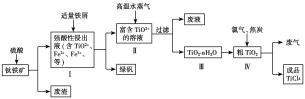
已知:TiO2+发生水解反应的化学方程式为TiO2++(n+1)H2O![]() TiO2·nH2O+2H+。
TiO2·nH2O+2H+。
(1)硫酸与TiO2反应的离子方程式是_________________________。
(2)由TiO2制取TiCl4时涉及的反应有:
TiO2(s)+2Cl2(g)+2C(s)===TiCl4(g)+2CO(g) ΔH1=-72 kJ·mol-1;
TiO2(s)+2Cl2(g)===TiCl4(g)+O2(g)
ΔH2=+38.8 kJ·mol-1;
C(s)+CO2(g)===2CO(g)
ΔH3=+282.8 kJ·mol-1。
①反应C(s)+CO2(g)===2CO(g)在高温下能够自发进行的原因是____________________。
②反应C(s)+O2(g)===CO2(g)的ΔH=________。
(3)向Ⅰ中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:2Fe3++Fe===3Fe2+;2TiO2+(无色)+Fe+4H+===2Ti3+(紫色)+Fe2++2H2O;Ti3+(紫色)+Fe3++H2O===TiO2+(无色)+Fe2++2H+。
①结合信息判断Fe3+、TiO2+、Fe2+的氧化性强弱关系:________>________>________。
②加入铁屑的作用是_____________________。
(4)向Ⅱ中不断通入高温水蒸气,维持溶液沸腾一段时间,析出水合二氧化钛沉淀。请用化学平衡理论分析通入高温水蒸气的作用:_________________________。
(5)依据绿色化学理念,该工艺流程中存在的不足之处是_________________________(写出一条即可)。
(6)工业上可通过电解TiO2来获得Ti(同时产生O2):处理过的TiO2为阴极,石墨为阳极,熔融CaCl2为电解液,电解槽中加入炭块。阴极反应式为_____________________;
电解过程中需定期向电解槽中加入炭块的原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是 。
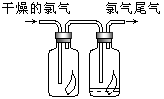
(2)为防止氯气尾气污染空气,根据氯水显酸性的性质,可用 溶液吸收多余的氯气,原理是(用化学方程式表示)______________________________。
(3)根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是__________(填化学式),长期露置于空气中的漂白粉,加稀盐酸后产生的气体是__________(用字母代号填)。
A.O2 B.H2 C.CO2 D.HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是电解 CuCl2溶液的装置,其中 c、d 为石墨电极。则下列有关的判断正确的是

A. a 为负极、b 为正极 B. a 为阳极、b 为阴极
C. 电解过程中,d 电极质量增加 D. 电解过程中,氯离子浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只能被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是( )
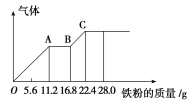
A.混合酸液中NO![]() 的物质的量为0.4 mol
的物质的量为0.4 mol
B.OA段产生是NO,AB段反应为2Fe3++Fe=3Fe2+,BC段产生氢气
C.溶液中最终溶质为FeSO4
D.c(H2SO4)为5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在蒸发皿中用酒精灯加热蒸干下列物质的溶液然后灼烧,可以得到该物质的固体的是( )
A. AlCl3 B. MgSO4 C. (NH4)2CO3 D. NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
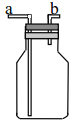
(1)排空气法收集气体,若收集 CO2气体,进气口为____________(填“a”或“b”)
(2)若瓶中装满水,可用于收集下列气体中的_____________(选填编号)
①NO ②NO2③NH3④HCl
(3)如果广口瓶中盛放浓硫酸,可以用作气体干燥装置,则该装置不可以干燥的气体有_________(选填编号)
①HCl ②H2③NH3④CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温、常压下,饱和CO2溶液的pH为3.9,用标准浓度的盐酸来滴定锥形瓶中放置时间较长的氢氧化钠溶液,应选用的指示剂及滴定终点颜色变化的情况最好是( )
A.石蕊,由蓝变红 B.酚酞,红色褪去
C.甲基橙,由黄变橙 D.甲基橙,由橙变黄
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com