
欲用98%的浓硫酸,(密度为1.84g/cm3)配制成浓度为0.5mol/L的稀硫酸500ml.
(1)请将下列各操作,按正确的序号填在横线上.
A.用量筒量取浓H2SO4
B.反复颠倒摇匀
C.用胶头滴管加蒸馏水至刻度线
D.洗净所用仪器
E.稀释浓H2SO4F.将溶液转入容量瓶
其操作正确的顺序依次为 D、A、E、D、C、B .
(2)简要回答下列问题:(每空1分,共9分)
①所需浓硫酸的体积为 mL.
②如果实验室有15mL、20mL、50mL的量筒应选用 mL的量筒最好,量取时发现量筒不干净用水洗净后直接量取将使浓度 (“偏高”、“偏低”、“无影响”以下同)
③将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并用玻璃棒不断搅拌,若搅拌过程中有液体溅出,结果会使所配溶液浓度 .
④在转入容量瓶前烧杯中液体应 静置冷却 ,否则会使浓度 ;并洗涤烧杯和玻璃棒2~3次,洗涤液也要转入容量瓶,否则会使浓度 .
⑤定容时必须使溶液凹液面与刻度线相切,若俯视会使浓度 ;仰视则使浓度 .
| 配制一定物质的量浓度的溶液.. | |
| 专题: | 实验题. |
| 分析: | (1)根据实验操作的步骤解答; (2)先根据c= |
| 解答: | 解:(1)配制稀硫酸的步骤为:计算→量取→稀释、冷却→移液→定容→摇匀→装瓶→贴签,所以正确的顺序为:D、A、E、D、C、B; 故答案为:D、A、E、D、C、B; (2)①②C= 解得:V=13.6ml,所以需要浓硫酸13.6ml,应选择15ml的量筒;量取时发现量筒不干净,用水洗净后直接量取浓硫酸,相当于稀释浓硫酸,量取的硫酸溶液中含硫酸的物质的量偏小,溶液的浓度偏低; 故答案为:①13.6; ②15 偏低; ③搅拌过程中有液体溅出,导致溶质的物质的量偏小,溶液的浓度偏低; 故答案为:偏低; ④容量瓶不能盛放过热液体,溶解或者稀释后应待冷却后再移液,否则会导致溶液的体积偏小,溶液的浓度偏高;烧杯内壁、玻璃棒上沾有溶质,不洗涤,会导致溶质的物质的量偏小,溶液的浓度偏低; 故答案为:静置冷却 偏高 偏低; ⑤定容时必须使溶液凹液面与刻度线相切,若俯视会导致溶液的体积偏小,溶液的浓度偏高;仰视会导致溶液的体积偏大,溶液的浓度偏低; 故答案为:偏高 偏低. |
| 点评: | 本题考查了配制一定物质的量浓度的溶液的方法,侧重对学生能力的培养和解题方法的指导和训练,熟悉配置原理和过程是解题关键,注意物质的量浓度与质量百分数浓度之间的换算. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
与171g Al2(SO4)3中所含的SO42-数目相同的Na2SO4的质量是多少?将171g Al2(SO4)3和142g Na2SO4混合,其混合物的平均摩尔质量是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 标准状况下,6.02×1023个分子所占的体积约是22.4L |
|
| B. | 0.5molH2所占体积为11.2L |
|
| C. | 标准状况下,1mol水的体积为22.4L |
|
| D. | 标准状况下,28gCO与N2的混和气体的体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
|
| A. | 纯碱、烧碱均属碱 |
|
| B. | CO、SO2均属酸性氧化物 |
|
| C. | 凡能电离出H+的化合物均属酸 |
|
| D. | 盐类物质一定含有金属离子或铵根离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A、煤燃烧是化学能转化为光能的过程
B、1 mol 甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
C、HCl 和 NaOH 反应的中和热 ΔH=-57.3 kJ·mol-1,则 H2SO4 和 Ca(OH)2 反应中和热
ΔH=2×(-57.3)kJ·mol-1
D、反应 H2(g)+F2(g)===2HF(g);ΔH=-270 kJ·mol-1说明在相同条件下,1 mol 氢气与 1 mol 氟气的能量总和大于2 mol 氟化氢气体的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车尾气里含有的NO气体是由内燃机燃烧时产生的高温引起氮气和氧气反应所致:N2(g)+O2(g) 2NO(g)
2NO(g) 
已知该反应在 2404℃时,平衡常数 K=6.4×10-3。请回答下列问题。
2404℃时,平衡常数 K=6.4×10-3。请回答下列问题。
(1)该反应的平衡常数表达式为 。
(2)该温度下,向 2 L 密闭容器中充入 N2 和 O2 各 1 mol,平衡时,N2 的转化率是 %(保留整数)。
(3)该温度下,某时刻测得容器内 N2、O2、NO的浓度分别为2.5×10-1mol·L-1、4.0×10-2mol·L-1和3.0×10-3mol·L-1,此时反应________(填“处于化学平衡状态”、“向正方向进行”或“向逆方向进行”),理由是_______。
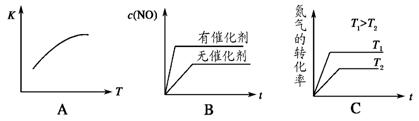
(4)将 N2、O2 的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是_________。
(5)向恒温恒容的密闭容器中充入等物质的量的 N2 和 O2,达到平衡状态后再向其中充入一定量 NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数_________(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
三硅酸镁被用来治疗胃酸过多的胃溃疡,是因为该物质不溶于水,服用后能中和胃酸,作用持久。把三硅酸镁Mg2Si3O8·nH2O改写成氧化物的形式为________,它中和胃酸(HCl)的化学方程式是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com