
| A. | 蓝色逐渐消失的原因是Na2SO3溶液具有漂白性 | |
| B. | 第一步反应的离子方程式ClO-+2I-+2H+═I2+Cl-+H2O | |
| C. | 淀粉KI溶液变蓝是因为I-被氧化为I2,I2使淀粉变蓝色 | |
| D. | 微粒的氧化性由强到弱的顺序是ClO->I2>SO${\;}_{4}^{2-}$ |
分析 第一步中发生:NaClO+2KI+H2SO4═I2+NaCl+K2SO4+H2O,第二步发生:Na2SO3+I2+H2O═Na2SO4+2HI,均为氧化还原反应,结合物质的性质及氧化剂的氧化性大于氧化产物的氧化性来解答.
解答 解:A.由第二步反应可知,S元素的化合价升高,则蓝色消失的原因是Na2SO3溶液具有还原性,故A错误;
B.由第一步反应可知,淀粉KI溶液变蓝是因为I-被氧化为I2,淀粉遇I2变蓝,所以反应的方程式为:ClO-+2I-+2H+═I2+Cl-+H2O,故B正确;
C.由第一步反应可知,淀粉KI溶液变蓝是因为I-被氧化为I2,淀粉遇I2变蓝,故C正确;
D.由NaClO+2KI+H2SO4═I2+NaCl+K2SO4+H2O,ClO-的氧化性大于I2的氧化性,由Na2SO3+I2+H2O═Na2SO4+2HI,I2的氧化性大于SO4 2-的氧化性,所以氧化性强弱为:ClO->I2>SO42-,故D正确;
故选:A.
点评 本题以卤族元素及化合物的性质考查氧化还原反应,把握发生的化学反应为解答的关键,注意利用氧化还原反应中的规律性知识来解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Na2O2是碱性氧化物,SO2是酸性氧化物 | |
| B. | 分别加热用Cl2、SO2和Na2O2漂白过的品红溶液都能恢复红色 | |
| C. | 将Cl2和SO2同时通入水中能生成两种强电解质 | |
| D. | Cl2、SO2和Na2O2漂白原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +6 | B. | +3 | C. | +2 | D. | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
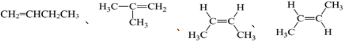 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
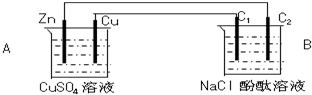 Ⅰ.按图装置进行实验,并回答下列问题.
Ⅰ.按图装置进行实验,并回答下列问题. Ⅱ.(1)电工经常说的一句口头禅:“铜接铝,瞎糊弄”,所以电工操作上规定不能把铜导线与铝导线连接在一起使用,说明原因:铜与铝连接会构成原电池,其中铝为原电池的负极,铜为原电池的正极.构成原电池后,铝的腐蚀速度大大加快,电阻增大,放热增多,时间长了,有可能引发火灾.
Ⅱ.(1)电工经常说的一句口头禅:“铜接铝,瞎糊弄”,所以电工操作上规定不能把铜导线与铝导线连接在一起使用,说明原因:铜与铝连接会构成原电池,其中铝为原电池的负极,铜为原电池的正极.构成原电池后,铝的腐蚀速度大大加快,电阻增大,放热增多,时间长了,有可能引发火灾.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
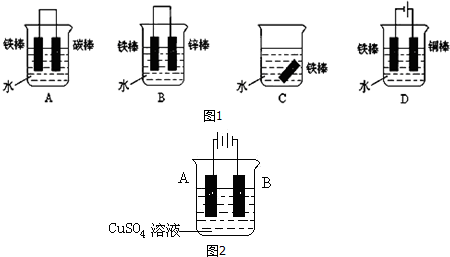
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
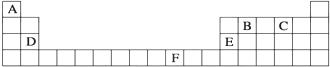
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCl2和足量的铁加热条件下反应,转移电子数一定为3NA | |
| B. | 常温常压下,8.8g CO2和N2O的混合气体所含电子数为4.4 NA | |
| C. | 常温下,PH=13的Ba(OH)2 溶液,0.1L,含OH-,0.02NA | |
| D. | 1 L 1 mol/L的乙醇水溶液中含有氢原子总数为6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com