
科目:高中化学 来源: 题型:
| CuO/CuCl3 | 400℃ |



 2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol
2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol 2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol
2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol
查看答案和解析>>
科目:高中化学 来源:2013届新课标高三配套月考(二)化学试卷(A卷)(带解析) 题型:填空题
[2012·北京大兴一模](11分)下表为元素周期表的一部分,请参照①-⑦相关元素在表中的位置,用化学用语回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序为 ;②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 。
(2)由②④⑤三种元素组成的常见物质的水溶液显碱性,用离子方程式表示溶液显碱性的原因:________ ___。
(3)甲、乙是由②③④三种元素中一种或两种元素形成的双原子分子或负二价阴离子,它们的电子总数相等,甲与钙元素组成的化合物既含离子键又含非极性共价键,则该化合物的电子式为:__________,乙是一种常用的还原剂,请用化学方程式表示它在工业上的一种重要用途:__________ __。
(4)已知在25℃、101 kPa下,⑦的气态氢化物在氧气中完全燃烧后恢复至原状态,每转移l mol电子时放热190.0kJ,该反应的热化学方程式可表示为____ 。
(5)以⑥的单质材料为阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成有吸附性的难溶物R,写出阳极生成R的电极反应式:_______ ____。
查看答案和解析>>
科目:高中化学 来源:2013届新课标高三配套月考(二)化学试卷(A卷)(带解析) 题型:填空题
[2012·北京卷,节选](6分)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。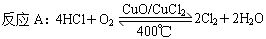
已知:i.反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。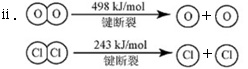
(1)H2O的电子式是____________。
(2)反应A的热化学方程式是___________________________________。
(3)断开1 mol H-O键与断开1 mol H-Cl键所需能量相差约为________kJ,H2O中H-O键比HCl中H-Cl键(填“强”或“弱”)________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年新课标高三配套月考(二)化学试卷(A卷)(解析版) 题型:推断题
[2012·北京怀柔一模](11分)金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,转化关系如下:
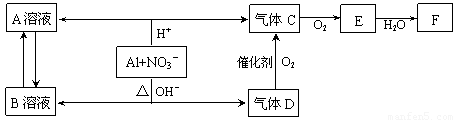
已知:气体D和F反应可生成盐,气体D和A溶液反应生成白色沉淀。
请回答下列问题
(1)A和B两溶液混合产生白色沉淀,该白色沉淀的化学式 。
(2)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质的电子式 。
(3)完成并配平下列离子方程式:Al+NO3-+OH-+H2O— + 。
(4)过量D的水溶液与A溶液反应的离子方程式是 。
(5)D→C反应的化学方程式是 。
(6)除去气体C中的杂质气体E的化学方法: (用化学方程式表示)。
(7)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com