
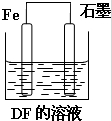
 A、B、C、D、E、F六种短周期主族元素,其原子序数依次增大.A、D同主族;A与B、C均可形成多种常见的10电子微粒;在同一周期中,简单离子半径E的最小,原子半径F的最小;B的单质分子中有三对共用电子对.请回答下列问题:
A、B、C、D、E、F六种短周期主族元素,其原子序数依次增大.A、D同主族;A与B、C均可形成多种常见的10电子微粒;在同一周期中,简单离子半径E的最小,原子半径F的最小;B的单质分子中有三对共用电子对.请回答下列问题: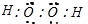 ,故答案为:
,故答案为: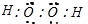 ;
;

 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
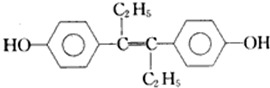
| A、该有机物分子中,最多可能有18个碳原子共平面 |
| B、该分子中有7个碳碳双键,可以与氢气1:7加成 |
| C、该分子对称性好,所以没有顺反异构 |
| D、标况下,1mol该有机物与足量金属钠反应可以放出22.4L的氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | X | Y | Z |
| 初始物质的量(mol) | 0.2 | 0.2 | 0 |
| 平衡物质的量(mol) | 0.1 | 0.05 | 0.1 |
| A、反应可表示为2X+3Y?2Z,其平衡常数为8000 |
| B、增大压强使平衡向生成Z的方向移动,平衡常数增大 |
| C、若将容器的体积压缩至1L,则X的体积分数减小,浓度增大 |
| D、若升高温度时,Z的浓度增大,可知温度升高时正反应速率增大,逆反应速率减小,平衡朝正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑥ | B、①③⑤ |
| C、③④⑤ | D、②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
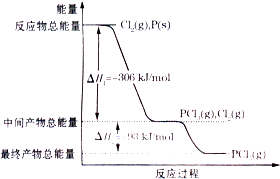 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).下列说法正确的是( )
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).下列说法正确的是( )| A、P(s)和Cl2(g)一步直接生成1 mol PCl5(g) 的△H小于△H1+△H2 |
| B、PCl5(g)?PCl3(g)+Cl2(g)加入催化剂,达平衡时PCl5的分解率减小 |
| C、生成PCl3(g)的热化学方程式为2P(s)+3Cl2(g)=2PCl3(g)△H=-306 KJ/mol |
| D、工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,降温后,再和Cl2反应生成PCl5,这样有助于提高产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 写出下列反应的热化学方程式.
写出下列反应的热化学方程式.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷(CH4) |
| B、一溴甲烷(CH3Br) |
| C、乙烯(CH2═CH2) |
| D、CH2═C-HC≡CH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com