



科目:高中化学 来源: 题型:
| A、在含有Fe(SCN)3的红色溶液中加入3~5滴NaOH稀溶液,振荡静置,混合溶液颜色变浅 |
| B、把盛有NO2(g)、N2O4(g)组成的平衡体系的容器放入到热水中,混合气体的颜色加深 |
| C、反应2NO2(g)═O2(g)+2NO(g)△H<0,达到平衡后,减小压强混合气体颜色变浅 |
| D、使用催化剂可加快SO2转化为SO3的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
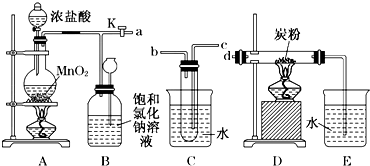

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制一定物质的量浓度的硫酸溶液时.只需使用1次玻璃棒 |
| B、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| C、蒸馏操作时,应使温度计水银球插入液面以下 |
| D、碘水不可用于鉴别苯、四氯化碳、乙醇三种无色液体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com