
| V |
| Vm |
| m |
| n |
| 56L |
| 22.4L/mol |
| 30g |
| 16g/mol |
| 15 |
| 8 |
| 15 |
| 8 |
| 5 |
| 8 |
| 15 |
| 8 |
| 5 |
| 8 |
| 35.0g | ||
|


科目:高中化学 来源: 题型:
| A、用过滤的方法不能净化胶体 |
| B、胶体稳定是由于胶体带同种电荷,相互排斥 |
| C、向氢氧化铁胶体中加入稀盐酸,胶体先聚沉,后溶解 |
| D、一束平行光照射蛋白质溶液时,从侧面可以看到光亮通路 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| C-F | 427 | C-Cl | 330 | C-I | 218 |
| H-H | 436 | S=S | 255 | H-S | 339 |
查看答案和解析>>
科目:高中化学 来源: 题型:
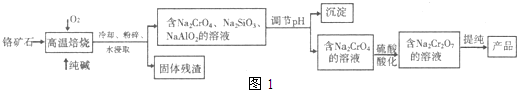
 ①钠离子交换膜的一种材料是聚丙烯酸钠
①钠离子交换膜的一种材料是聚丙烯酸钠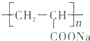 ,聚丙烯酸钠单体的结构简式是
,聚丙烯酸钠单体的结构简式是2- 7 |
2- 7 |
| 3 | 0.4 |
| 3 | 4 |
| 3 | 6 |
| 3 | 60 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度时,在一个0.5L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.
某温度时,在一个0.5L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com