
| A. | 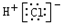 | |
| B. | NH4Br的电子式: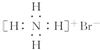 | |
| C. | N2的结构式: | |
| D. | 原子核内有18个中子的氯原子:3517Cl |
分析 A.氯化氢为共价化合物,分子中不存在阴阳离子;
B.溴离子为阴离子,电子式中需要标出最外层电子;
C.氮气的结构式中不需要标出未成键电子对;
D.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数.
解答 解:A.氯化氢为共价化合物,氯原子最外层达到8个电子稳定结构,氯化氢的电子式为 ,故A错误;
,故A错误;
B.NH4Br为离子化合物,铵根离子为复杂阳离子,阴阳离子都需要标出所带电荷及最外层电子,其正确的电子式为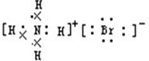 ,故B错误;
,故B错误;
C.氮气分子中含有氮氮三键,其正确的结构式为:N≡N,故C错误;
D.原子核内有18个中子的氯原子质量数为35,该原子正确的表示方法为:3517Cl,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、结构式、元素符号等知识,明确常见化学用语的书写原则为解答结构,试题培养了学生的规范答题能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ③⑤④⑤② | B. | ③⑤② | C. | ③⑤①② | D. | ③⑤①⑤② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氢原子的电子云图中,每个小黑点代表一个电子 | |
| B. | 某基态原子3d能级中电子排布的情况可能为 | |
| C. | 电子构型为[Ar]3d104s2的元素是过渡金属元素 | |
| D. | 当碳原子的核外电子排布由1s22s22p2转变为1s22s12p3时,碳原子由基态变为激发态 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
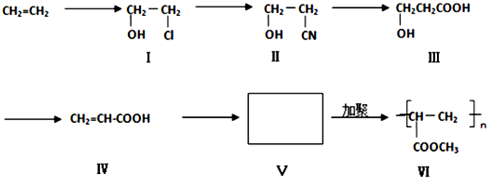
 CH2=CH-COOCH3+H2O、n CH2=CH-COOCH3$\stackrel{催化剂}{→}$
CH2=CH-COOCH3+H2O、n CH2=CH-COOCH3$\stackrel{催化剂}{→}$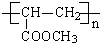 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式为:CH2CH2 | B. | H2O的电子式: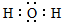 | ||
| C. | 葡萄糖的分子式:C12H22O11 | D. | 14C的原子结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取代反应,4 mol Cl2 | B. | 加成反应,2 mol Cl2 | ||
| C. | 加成反应、取代反应,3 mol Cl2 | D. | 加成反应、取代反应,2 mol Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO的电子式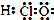 | |
| B. | 比例模型 :可以表示CH4,也可以表示CCl4 :可以表示CH4,也可以表示CCl4 | |
| C. | 乙烯的结构简式:CH2CH2 | |
| D. | 碳酸氢根电离:HCO3-?H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com