
����Ŀ��NiCl2�ǻ����ϳ�������Ҫ����Դ����ҵ�����ú���(Ni)�ϴ�������Ҫ����Ni��������SiO2��Al2O3��Fe�������������ᡢ������ʣ������Ȼ������壨NiCl2��nH2O���������£�
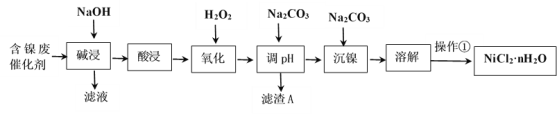
���ֽ�����������Ksp����ֵ���±���ʾ��
��ѧʽ | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp����ֵ | 10-17 | 10-38 | 10-34 | 10-15 |
�ش��������⣺
��1��Ni��ԭ������Ϊ28��λ��Ԫ�����ڱ��������ڣ�����������Ϊ2������ԭ�ӽṹʾ��ͼΪ________________��
��2��������������ܽ�����ʹ�õ���Ϊ_____________���������ʱ������Ӧ�����ӷ���ʽΪSiO2+2OH-=SiO32-+H2O��___________________��
��3��������������H2O2��Һ����������____________________(�����ӷ���ʽ��ʾ)��Ȼ�����pHʹ��Һ����Ԫ��ǡ����ȫ����������Ũ����10-5mol��L-1ʱ�����ӳ�����ȫ������ʱ�����µ�pHԼΪ____________��
��4��������������ʵ���������Ϊ�������ȣ�Ũ����_________________________Ϊֹ����ȴ�ᾧ�����ˡ�ϴ�ӡ�������ò�Ʒ��
��5��Ϊ�˲ⶨNiCl2nH2O�нᾧˮ��Ŀ��������ʵ�飺ȡ23.8 g��Ʒ��һ����������ˮ��13.0 g NiCl2����n=__________��
��6���������ѳ�Ϊ��϶�����������Ҫ������ͣ����ڼ��Ե������Һ�Ĺ���ԭ�����£�M+Ni(OH)2![]() MH+NiOOH(ʽ��MΪ����Ͻ�)��д����س������������ĵ缫��Ӧʽ__________________��
MH+NiOOH(ʽ��MΪ����Ͻ�)��д����س������������ĵ缫��Ӧʽ__________________��
���𰸡�![]() ���� Al2O3+2OH-=2AlO2-+H2O
���� Al2O3+2OH-=2AlO2-+H2O ![]() 3 ��Һ������ֽᾧ��Ĥ 6 Ni(OH)2+OH-- e-=NiOOH+H2O
3 ��Һ������ֽᾧ��Ĥ 6 Ni(OH)2+OH-- e-=NiOOH+H2O
��������
ij����(Ni)�ϴ�������Ҫ����Ni��������SiO2��Al2O3��Fe�������������ᡢ������ʣ��������̵�Ŀ�����ú����ϴ����Ʊ�NiCl2nH2O���壬�����������̣�����Ni�ϴ�����NaOH��Һ���ݣ�SiO2��Al2O3����NaOH���ɿ�����ˮ��Na2SiO3��NaAlO2�����й��˲�������������ΪFe��Ni�����������ڼ�����ʣ��ٽ����������Fe��Ni�������γ�Fe2+��Ni2+�����й��˲�������������������ʱ����˳�����Һ����Ҫ����Fe2+��Ni2+����H2O2������Һ�е�Fe2+����Fe3+���ټ��� Na2CO3��Һ������ҺpH��ʹFe3+��ȫת��ΪFe(OH)3���������˺���Һ���ټ����μ�Na2CO3��Һ����Ni(OH)2����������������Ni(OH)2�����������ܽ⣬������Ũ������ȴ�ᾧ�����˼���NiCl2nH2O���壬�ݴ˷�����
(1)Ni��ԭ������Ϊ28��λ��Ԫ�����ڱ��������ڣ�������4�����Ӳ㣬������������Ϊ2������ԭ�ӽṹʾ��ͼΪ![]() ��
��
(2)���������̵�Ŀ�����ú����ϴ����Ʊ�NiCl2nH2O���壬��������������ܽ�����ʹ�õ���Ϊϡ����������ʱSiO2��Al2O3����NaOH���ɿ�����ˮ��Na2SiO3��NaAlO2��������Ӧ�����ӷ���ʽΪSiO2+2OH-=SiO32-+H2O��Al2O3+2OH-=2AlO2-+H2O��
(3)��Fe3+�����γ�Fe(OH)3�ﵽȥ��FeԪ�ص�Ŀ�ģ������H2O2��Һ��Ŀ��������Fe2+ΪFe3+�����������ӷ�ӦΪ2Fe2++H2O2+2H+=2Fe3++2H2O������pHʹ��Һ����Ԫ��ǡ����ȫ���������Է�����������Һ��c(Fe3+)Ũ�ȵ���10-5mol/L����ΪFe3+������ȫ����ȥ����ʱ��Һ��c(OH-)=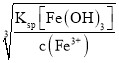 =10-11mol/L����pH=14-pOH=14+lgc(OH-)=3��
=10-11mol/L����pH=14-pOH=14+lgc(OH-)=3��
(4)������������Ŀ��Ϊ����Һ�л��NiCl2nH2O���壬��������Ϊ�������ȣ�Ũ������Һ������ֽᾧ��ĤΪֹ���پ���ȴ�ᾧ�����ˡ�ϴ�ӡ�������ò�Ʒ��
(5)23.8 g��Ʒ��һ����������ˮ��13.0 g NiCl2������ˮ������Ϊ23.8g-13.0g=10.8g����n=![]() =
= =6��
=6��
(6)�������ڼ��Ե������Һ�Ĺ���ԭ�����£�M+Ni(OH)2![]() MH+NiOOH�����ʱ������Ni(OH)2����������Ӧ������NiOOH���������ĵ缫��ӦʽΪNi(OH)2+OH-- e-=NiOOH+H2O��
MH+NiOOH�����ʱ������Ni(OH)2����������Ӧ������NiOOH���������ĵ缫��ӦʽΪNi(OH)2+OH-- e-=NiOOH+H2O��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ķ��ӽṹ�ɼ�д�ɼ���ʽ�ṹ![]() ���л���A�ļ���ʽ�ṹΪ
���л���A�ļ���ʽ�ṹΪ![]() ���л���B������ʵ�����H2�����ӳɷ�Ӧ�ɵõ��л���A�������й�˵��������ǣ� ��
���л���B������ʵ�����H2�����ӳɷ�Ӧ�ɵõ��л���A�������й�˵��������ǣ� ��
A.�л���A��һ��ȡ����ֻ��4��
B.��ϵͳ�����������л���A������Ϊ2��2��3��������
C.�л���A�ķ���ʽΪC8H18
D.B�Ľṹ������3�֣�����һ������Ϊ3��4��4����2��ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ijһ��������ɱ���ܱ������з�����Ӧ��A(g)+B(g)![]() 2C(g)����H<0��t1ʱ�̴ﵽƽ�����t2ʱ�̸ı�ijһ�������䷴Ӧ��������ͼ��ʾ������˵����ȷ����( )
2C(g)����H<0��t1ʱ�̴ﵽƽ�����t2ʱ�̸ı�ijһ�������䷴Ӧ��������ͼ��ʾ������˵����ȷ����( )
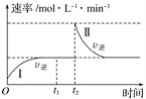
A.O��t2ʱ��v��>v��
B.�������̴ﵽƽ��ʱ��A�����������>��
C.t2ʱ�̸ı�����������ܱ������м�C
D.�������̴ﵽƽ��ʱ��ƽ�ⳣ����<��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ���Ũ�ȵ�ZnSO4��CuSO4�Ļ����Һ�У���μ���1.5 mol��L1��Na2S��Һֱ����Һ������������Ȼ����ˡ���֪��Ksp(ZnS)=2.0��1022��Ksp(CuS)=1.3��1036������˵������ȷ����
A.������CuS������ZnS���������ڳ�����ת��
B.��ZnS������ȫʱ����Һ��![]() =6.5��1015
=6.5��1015
C.���˵õ��ij�����CuS��ZnS�Ļ����
D.���˺�õ�����Һ�����м�������Cu2+��Zn2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��д��������̣�����һ���¶��µ��ܱ������д������·�Ӧ��2SO2(g) + O2(g)![]() 2SO3(g)����֪c(SO2)ʼ=0.4mol/L��c(O2)ʼ=1mol/L�����ⶨ�÷�Ӧ�ڸ��¶��µ�ƽ�ⳣ��K��19�����жϣ�
2SO3(g)����֪c(SO2)ʼ=0.4mol/L��c(O2)ʼ=1mol/L�����ⶨ�÷�Ӧ�ڸ��¶��µ�ƽ�ⳣ��K��19�����жϣ�
��1����SO2ת����Ϊ50��ʱ���÷�Ӧ�Ƿ�ﵽƽ��״̬��________����δ�ﵽ���ĸ�������У�__________
��2����ƽ��״̬ʱ�� SO2��ת����ӦΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йس�������ʽ����ȷ����( )��
A.NH3��H2O ![]() NH4+ + OH��Ka =
NH4+ + OH��Ka =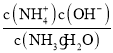
B.CH3CH2COO - + H2O![]() CH3CH2COOH +OH- Kh =
CH3CH2COOH +OH- Kh = 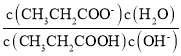
C.AgCl(s) ![]() Ag��(aq)��Cl��(aq) Ksp = c��Ag����c��Cl����
Ag��(aq)��Cl��(aq) Ksp = c��Ag����c��Cl����
D.FeO(s)��CO(g) ![]() Fe(s)��CO2(g) K =
Fe(s)��CO2(g) K =![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȼ�ϵ��Ϊ��Դ���е���ʵ��װ����ͼ��ʾ������˵���У��������( )��
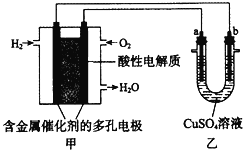
A.ȼ�ϵ����ͨ������һ�˵Ķ�缫Ϊ����
B.ȼ�ϵ�ع���ʱ��������ӦΪ��O2 + 2H2O + 4e��= 4 OH��
C.��ȼ�ϵ�ص��ܷ�ӦʽΪ��2H2+O2=2H2O
D.��װ�ÿ�ʵ�ֽ�����ת��Ϊ��ѧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��pNi= -lg c(Ni2+)��������H2S�ĵ���ƽ�ⳣ��:Kal=l. 3��10-7��Ka2=7. 1��10-15�������£���10 mL 0. 1 molL-1Ni(NO3)2��Һ�еμ�0.1 molL-1Na2S��Һ���μӹ�����pNi��Na2S��Һ����Ĺ�ϵ��ͼ��ʾ������˵����ȷ����

A.E��F��G�����У�F���Ӧ��Һ��ˮ����̶����
B.�����£�Ksp(NiS) = 1��10-21
C.Na2S��Һ�� c(S2- )+c(HS- )+c(H2S) =c(Na+)
D.Na2S��Һ�У�S2-��һ��ˮ�ⳣ��Kh1=![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ӱ�����ǵ������뽡����ij�����������п��ܺ������¿����������ӣ�Na+��NH4+��Mg2+��Al3+��SO42����NO3����Cl�� ��ijͬѧ�ռ��˸õ���������������Ҫ��Ԥ������������Һ����Ʋ���������µ�ʵ�飺

��֪��3NO3��+ 8Al + 5OH�� + 2H2O![]() 3NH3 + 8AlO2��
3NH3 + 8AlO2��
�������ϵ�ʵ�����������ͬѧ�ó��Ľ�������ȷ����
�����п϶�����NH4+��Mg2+��SO42����NO3��
������һ������Al3+
�����п��ܴ���Na+��Cl��
�������п��ܴ���NaNO3 ��NH4Cl��MgSO4
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com