
| A. | Na2CO3 | B. | KMnO4 | C. | KOH | D. | H2SO4 |
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 有机充电电池具有不含重金属,受资源限制少等优点而备受瞩目.某PYT-锂电池总反应如图,下列叙述不正确的是( )
有机充电电池具有不含重金属,受资源限制少等优点而备受瞩目.某PYT-锂电池总反应如图,下列叙述不正确的是( )| A. | PYT分子式为C16H6O4 | B. | 不能采用水溶液作为电解质溶液 | ||
| C. | 充电时,负极反应为Li-e-=Li+ | D. | 放电时,Li+向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
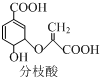 ,下列关于分枝酸的说法不正确的是( )
,下列关于分枝酸的说法不正确的是( )| A. | 分子中含有3种含氧官能团 | |
| B. | 1 mol分枝酸最多可与3mol NaOH发生中和反应 | |
| C. | 在一定条件下可与乙醇、乙酸反应,且反应类型相同 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,但褪色原理不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.
碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.| 实验序号 | 样品质量/g | CO2体积/mL(已折算成标准状况下) |
| 1 | 0.542 | 44.82 |
| 2 | 0.542 | 44.80 |
| 3 | 0.542 | 44.78 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150ml 1mol/LNaCl溶液 | B. | 100ml 3mol/L KClO3溶液 | ||
| C. | 75ml 2mol/L MgCl2溶液 | D. | 50ml 1mol/L FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别加热,观察有无气体生成 | |
| B. | 制成稀溶液,再分别滴加同浓度的稀盐酸 | |
| C. | 制成稀溶液,分别加入CaCl2溶液 | |
| D. | 制成溶液,分别加入少量澄清的石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径比较:X<Y<Z<W | |
| B. | Y的氢化物沸点高于W的氢化物 | |
| C. | Y的氢化物稳定性一定弱于W的氢化物 | |
| D. | 短周期所有元素中,w的最高价氧化物的水化物酸性最强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com