
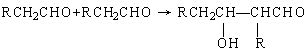

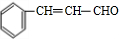 ;F
;F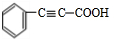 .
.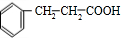 +
+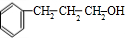 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$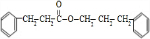 +H2O.
+H2O.分析 C分子式为C9H8O2,B发生银镜反应生成C,故B中含有醛基,C中含有-COOH,B的分子式为C9H8O,B的不饱和度为$\frac{2×9+2-8}{2}$=6,B属于芳香族化合物,苯环饱和度为4,-CHO不饱和度为1,故还含有1个C=C双键,A与乙醛加成生成B,由醛加成反应的信息可知,A为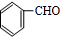 ,故B为
,故B为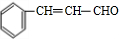 ,C为
,C为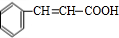 ,C与溴发生加成反应生成E,E为
,C与溴发生加成反应生成E,E为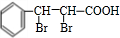 ,E在氢氧化钠醇溶液、加热条件下发生消去反应生成F,则F为
,E在氢氧化钠醇溶液、加热条件下发生消去反应生成F,则F为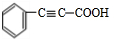 ,C与氢气加成生成D,D中含有-COOH,D与G反应生成H,H为酯,G含有-OH,H分子式为C18H20O2,不饱和度为$\frac{2×18+2-20}{2}$=9,故还含有2个苯环,故D为
,C与氢气加成生成D,D中含有-COOH,D与G反应生成H,H为酯,G含有-OH,H分子式为C18H20O2,不饱和度为$\frac{2×18+2-20}{2}$=9,故还含有2个苯环,故D为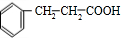 ,G为
,G为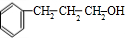 ,H为
,H为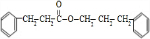 ,据此解答.
,据此解答.
解答 解:C分子式为C9H8O2,B发生银镜反应生成C,故B中含有醛基,C中含有-COOH,B的分子式为C9H8O,B的不饱和度为$\frac{2×9+2-8}{2}$=6,B属于芳香族化合物,苯环饱和度为4,-CHO不饱和度为1,故还含有1个C=C双键,A与乙醛加成生成B,由醛加成反应的信息可知,A为 ,故B为
,故B为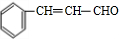 ,C为
,C为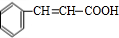 ,C与溴发生加成反应生成E,E为
,C与溴发生加成反应生成E,E为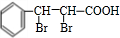 ,E在氢氧化钠醇溶液、加热条件下发生消去反应生成F,则F为
,E在氢氧化钠醇溶液、加热条件下发生消去反应生成F,则F为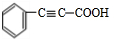 ,C与氢气加成生成D,D中含有-COOH,D与G反应生成H,H为酯,G含有-OH,H分子式为C18H20O2,不饱和度为$\frac{2×18+2-20}{2}$=9,故还含有2个苯环,故D为
,C与氢气加成生成D,D中含有-COOH,D与G反应生成H,H为酯,G含有-OH,H分子式为C18H20O2,不饱和度为$\frac{2×18+2-20}{2}$=9,故还含有2个苯环,故D为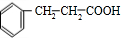 ,G为
,G为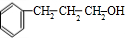 ,H为
,H为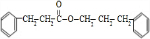 ,
,
(1)由上述分析可知,B为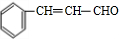 ,F为
,F为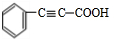 ,故答案为:
,故答案为: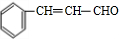 ;
;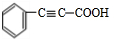 ;
;
(2)反应②是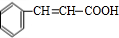 与溴发生加成反应生成
与溴发生加成反应生成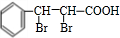 ,反应③是
,反应③是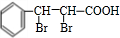 在氢氧化钠的醇溶液中发生消去反应生成
在氢氧化钠的醇溶液中发生消去反应生成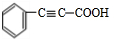 ,
,
故答案为:加成反应;消去反应;
(3)G与D反应生成H的化学方程式为: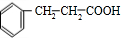 +
+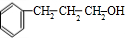 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$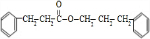 +H2O,
+H2O,
故答案为: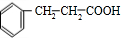 +
+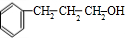 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$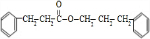 +H2O;
+H2O;
(4)F为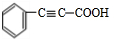 ,F若与H2发生加成反应,每摩F最多消耗的H2的物质的量为5mol,故答案为:5.
,F若与H2发生加成反应,每摩F最多消耗的H2的物质的量为5mol,故答案为:5.
点评 本题考查有机物推断,涉及烯烃、醇、羧酸、醛等性质,需要对给予的信息进行利用,是对有机化合物知识的综合考查,能较好的考查考生的自学能力和推理能力,难度中等,是高考热点题型


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,其中含有的化学键类型为离子键、非极性键
,其中含有的化学键类型为离子键、非极性键查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  研究的是温度、压强对平衡的影响,横坐标表示压强 | |
| B. | 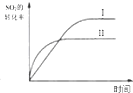 研究的是温度对平衡的影响,Ⅱ采用的温度更高 | |
| C. | 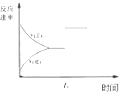 图中t0时使用了催化剂,使平衡向正反应方向进行 | |
| D. | 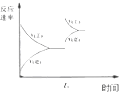 图中t0时增大压强,使平衡向正反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ② | B. | ②③ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol石炭酸根含有的电子数目为49NA | |
| B. | 标况下1L已烷完全燃烧后恢复至原状态,生成气态物质分子数为6 NA22.4 | |
| C. | 1mol甲基含有9NA个电子 | |
| D. | 0.1mol甘油与足量的钠反应,可生成氢气3.36L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
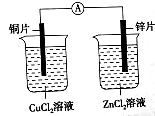 某实验小组拟用铜片、锌片、CuCl2溶液、ZnCl2溶液等设计原电池.并将装置图画到了如图所示程度.
某实验小组拟用铜片、锌片、CuCl2溶液、ZnCl2溶液等设计原电池.并将装置图画到了如图所示程度.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加铝粉能产生大量H2的溶液中:Na+、NH4+、NO3-、Cl- | |
| B. | 使甲基橙变红色的溶液中:K+、NH4+、HCO3-、Cl- | |
| C. | 由c(H+)/c(OH-)=10-12的溶液中:K+、Na+、ClO-、NO3- | |
| D. | 水电离出的c(H+)=10-12mol•L-1的溶液中:Mg2+、Cu2+、SO42-、K+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com