
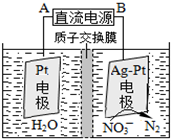
 氮氧化合物是大气污染的重要因素.
氮氧化合物是大气污染的重要因素.分析 (1)氮气和氧气在闪电的条件下转化为一氧化氮;
(2)根据盖斯定律来计算化学反应的焓变;
(3)根据氧化还原反应中氧化剂和还原剂的特点结合常见的氧化剂和还原剂来回答;
(4)①根据信息:用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强,即生成氢氧根离子,据此书写方程式;
②在电解池的阴极上发生得电子的还原反应,据此书写电极反应.
解答 解:(1)氮气和氧气在闪电的条件下转化为一氧化氮,反应为:N2+O2$\frac{\underline{\;放电或高温\;}}{\;}$2NO,故答案为:N2+O2$\frac{\underline{\;放电或高温\;}}{\;}$2NO;
(2)已知:①N2(g)+O2(g)═2NO(g)△H=+180.6kJ•mol-1
②C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
则反应 C(s)+2NO(g)═CO2(g)+N2(g)可以是②-①得到,所以该反应的△H=-393.5kJ•mol-1-180.6kJ•mol-1=-574.1kJ•mol-1,
C(s)+2NO(g)═CO2(g)+N2(g)△H=-574.1kJ•mol-1,
故答案为:-574.1;
(3)将NO2变成无害的N2中,氮元素的化合价降低了,二氧化氮做氧化剂,需要加入还原剂,在下列四种物质:a.NH3 b.CO2 c.SO2 d.CH3CH2OH中,能被二氧化氮氧化具有还原性的物质有乙醇和NH3,故答案为:还原剂;ad;
(4)①根据信息:用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强,即生成氢氧根离子,发生的反应为:2NO3-+5H2$\frac{\underline{\;催化剂\;}}{\;}$N2+2OH-+4H2O,
故答案为:2NO3-+5H2$\frac{\underline{\;催化剂\;}}{\;}$N2+2OH-+4H2O;
②根据装置图示可以看出,右端电极上发生得电子的还原反应,即为阴极,反应式为:2NO3-+12 H++10e-=N2↑+6H2O,所以B是负极,A是正极,
故答案为:A;2NO3-+12 H++10e-=N2↑+6H2O.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应与电化学的联系,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 由题目信息知:KMnO4的氧化性比MnO2的强 | |
| B. | 制备氯气的整个实验过程中,只需要使用氧化剂与还原剂 | |
| C. | 用排气法收集不需要利用其他试剂就能确定集气瓶中已收集满气体 | |
| D. | 用足量MnO2与含有4 molHCl的浓盐酸在加热条件下反应,得到Cl2的物质的量小于1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
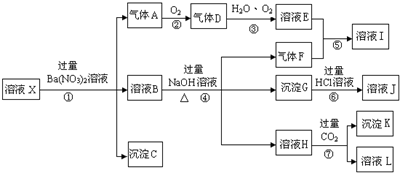
 ,沉淀K的化学式为:Al(OH)3,沉淀G的化学式为:Fe(OH)3,实验中,可以观察到反应②的现象是:气体由无色变红棕色.
,沉淀K的化学式为:Al(OH)3,沉淀G的化学式为:Fe(OH)3,实验中,可以观察到反应②的现象是:气体由无色变红棕色.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
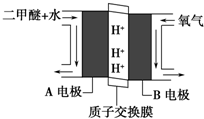 (1)二氧化碳是一种重要的温室气体,减少二氧化碳的排放是解决温室效应的有效途径.目前,由二氧化碳合成二甲醚的研究工作已取得了重大进展,其化学反应方程式为2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H>0.二甲醚气体的燃烧热为1455kJ•mol-1,工业上用合成气(CO、H2)直接或间接合成二甲醚.下列有关叙述正确的是AC.
(1)二氧化碳是一种重要的温室气体,减少二氧化碳的排放是解决温室效应的有效途径.目前,由二氧化碳合成二甲醚的研究工作已取得了重大进展,其化学反应方程式为2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H>0.二甲醚气体的燃烧热为1455kJ•mol-1,工业上用合成气(CO、H2)直接或间接合成二甲醚.下列有关叙述正确的是AC.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com