
 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.| c(标准)×V(标准) |
| V(待测) |
| c(标准)×V(标准) |
| V(待测) |
| 2×0.10mol/L×15.00mL |
| 1.00mL |


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
| A、2.05×10-4 |
| B、2.03×10-4 |
| C、1.28×10-4? |
| D、2.90×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
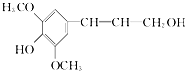
| A、芥子醇的分子式是C11H14O4,属于芳香烃 |
| B、芥子醇分子中所有碳原子不可能在同一平面上 |
| C、芥子醇与足量浓溴水反应,最多消耗1 mol Br2 |
| D、芥子醇能发生的反应类型有氧化、取代、加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
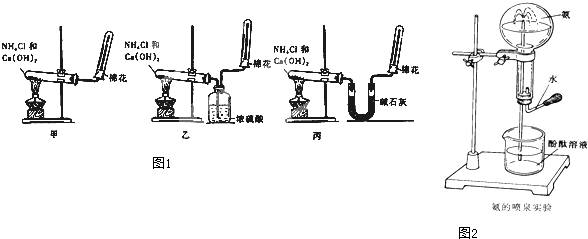
查看答案和解析>>
科目:高中化学 来源: 题型:
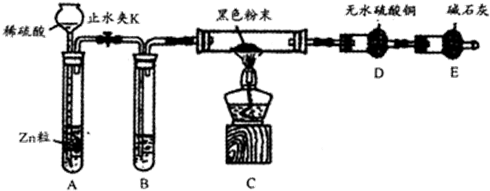
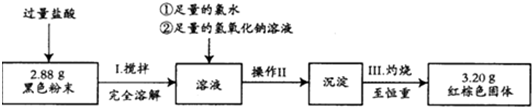
查看答案和解析>>
科目:高中化学 来源: 题型:
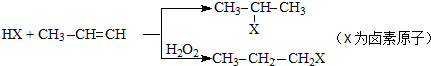
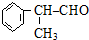 ,该物质是一种香料.
,该物质是一种香料.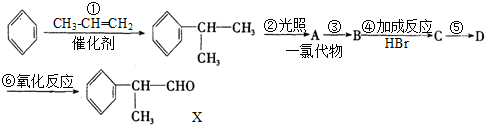
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴定前对碱式滴定管仰视读数,滴定后又俯视,会使测定结果偏高 |
| B、滴定管和锥形瓶使用之前均需用所装溶液润洗 |
| C、用酚酞做指示剂,滴定终点是当最后一滴NaOH溶液滴入时,溶液颜色由无色变为浅红色,且半分钟内不变色 |
| D、滴定前锥形瓶内含有少量水对实验结果无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入的酸过量 |
| B、生成的盐不水解 |
| C、酸和碱等物质的量混合 |
| D、反应后溶液中c(A-)=c(M+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com