

 .
.分析 碱性溶液能使湿润的红色石蕊试纸变蓝,取45.6g X加热到150℃时,发生非氧化还原反应,生成气体A和固体化合物B,收集到的气体A能使湿润的pH试纸显蓝色为氨气,根据氮原子守恒计算出45.6g X中氮原子的物质的量;乙醛和新制氢氧化铜发生氧化还原反应生成乙酸钠、氧化亚铜和水,把得到的B全部溶于水,均分为二份,实验过程二,砖红色沉淀D为氧化亚铜,氧化亚铜和稀硫酸反应可生成硫酸铜和铜,加稀硫酸和氧化亚铜发生氧化还原反应,红色沉淀为F为铜,蓝色溶液E为硫酸铜,据此分析解答.
解答 解:气体能使湿润的红色石蕊试纸变蓝,则气体的水溶液显碱性,则A为氨气,45.6g X加热到150℃时,发生非氧化还原反应,生成气体A的体积为17.92L(已折合为标准状况),物质的量为:n(NH3)=$\frac{17.92L}{22.4mol/L}$=0.8mol,把得到的B全部溶于水,均分为二份,加热氯化钡,发生:SO42-+Ba2+═BaSO4↓,白色沉淀E为BaSO4,n(SO42-)=n(BaSO4)=$\frac{23.3g}{233g/mol}$=0.1mol,45.6g X中n(SO42-)=0.2mol,在加热条件下,乙醛和新制氢氧化铜发生氧化还原反应生成乙酸、氧化亚铜和水,反应方程式为:CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O,把得到的B全部溶于水,均分为二份,实验过程二,加入过量的氢氧化钠溶液溶液呈碱性,加入乙醛溶液加热,得到砖红色沉淀D7.2g,为乙醛与氢氧化铜发生氧化还原反应生成氧化亚铜沉淀,n(Cu2O)=$\frac{7.2g}{144g/mol}$=0.05mol,45.6g X中n(Cu)=0.05×4mol=0.2mol,砖红色沉淀D为氧化亚铜,加稀硫酸,发生反应Cu2O+H2SO4=CuS04+Cu↓+H2O红色沉淀为F为铜,蓝色溶液E为硫酸铜,
(1)气体A为氨气,氨气为共价化合物,氨气中存在3个氮氢键,氮原子最外层达到8电子稳定结构,氨气的电子式为 ,
,
故答案为: ;
;
(2)45.6g X中n(SO42-)=0.2mol,n(Cu)=0.05×4mol=0.2mol,n(NH3)=$\frac{17.92L}{22.4mol/L}$=0.8mol,根据质量守恒:0.2mol×96g/mol+0.2mol×64g/mol+0.8mol×17g/mol=45.6g,则盐X的化学式为Cu(NH3)4SO4,X在150℃条件下分解的化学方程式为:Cu(NH3)4SO4$\frac{\underline{\;150℃\;}}{\;}$CuSO4+4NH3↑,
故答案为:Cu(NH3)4SO4;Cu(NH3)4SO4$\frac{\underline{\;150℃\;}}{\;}$CuSO4+4NH3↑;
(3)氧化亚铜和稀硫酸反应可生成硫酸铜和铜,红色沉淀为F为铜,铜和稀硝酸反应生成硝酸铜、一氧化氮和水,反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(4)砖红色沉淀D为氧化亚铜,D与FeCl3溶液(加过量盐酸)混合反应,酸性条件下:Cu2O+2H+=Cu2++Cu↓+H2O,FeCl3具有氧化性,能氧化Cu生成氯化铜,同时自身被还原生成氯化亚铁,离子方程式为2Fe3++Cu=2Fe2++Cu 2+,铁离子有可能剩余,所以反应后溶液存在的阳离子有:Fe2+、Cu2+、H+或Fe2+、Cu2+、H+、Fe3+,
故答案为:Fe2+、Cu2+、H+或Fe2+、Cu2+、H+、Fe3+.
点评 本题考查了物质组成的推断,涉及离子的检验、物质的性质等知识点,熟悉元素化合物的性质、知道流程图中每一步发生的反应及反应现象是解本题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色 | |
| B. | 若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色 | |
| C. | 该溶液中所含的离子是:Fe2+、Na+、SO42-、NO3- | |
| D. | 若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 30 | 40 | 50 |
| 生成 NH3量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (C6H10O5)n可以是淀粉或纤维素,二者均属于多糖,互为同分异构体 | |
| B. | 酸性高锰酸钾溶液可将乙醇氧化为乙酸,将烧黑的铜丝趁热插入乙醇中也可得到乙酸 | |
| C. | 可以利用银镜反应证明反应①的最终产物为葡萄糖 | |
| D. | 向反应②得到的混合物中倒入饱和氢氧化钠溶液并分液可得到纯净的乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羟基的电子式: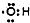 | |
| B. | 苯的分子式: | |
| C. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| D. | 甲烷分子的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往硫化氢水溶液中加碱有利于S2-的增加 | |
| B. | 加入催化剂有利于氨氧化的反应 | |
| C. | 高压不利于合成氨的反应 | |
| D. | 500℃左右比室温更有利于合成氨的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24 L | B. | 1.12 L | C. | 0.672 L | D. | 0.448 L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com