
为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。
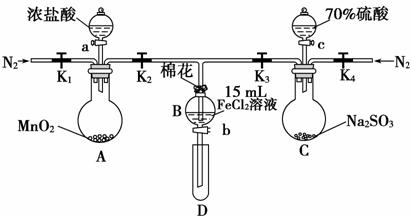
实验过程:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,关闭K2。
Ⅳ.打开活塞b,使约2 mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开K3和活塞c,加入70%的硫酸,一段时间后关闭K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是_____________________________________________________。
(2)棉花中浸润的溶液为_________________________________________________。
(3)A中发生反应的化学方程式___________________________________________。
(4)若将制取的SO2通入酸性高锰酸钾溶液可使溶液褪色,其离子方程式为________________________________________________________________________。
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是________(填“甲”、“乙”或“丙”)。
| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中 | |
| 甲 | 有Fe3+无Fe2+ | 有SO |
| 乙 | 既有Fe3+又有Fe2+ | 有SO |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
科目:高中化学 来源: 题型:
两种不同物质之间不可能存在的关系是( )
A.化学式相同,性质相同
B.最简式相同,化学式不同
C.相对分子质量相同,化学式不同
D.化学式相同,性质不同
查看答案和解析>>
科目:高中化学 来源: 题型:
对于可逆反应N2(g)+3H2(g) 2NH3(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是
2NH3(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是
A.υ(H2)=0.3mol/(L·min) B.υ(N2)=0.2mol/(L·min)
C.υ(NH3)=0.25mol/(L·min) D.υ(H2)=0.4mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.4mol丁烷完全燃烧后生成的气体全部缓慢通人1L 2mol/LNaOH溶液中,生Na2CO3和NaHCO3的物质的量之比为
A.3:2 B.2:3 C.2:1 D.1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验中,颜色的变化与氧化还原反应有关的是
A.往紫色石蕊试液中加入盐酸,溶液变红
B.饱和FeCl3溶液在沸水中变成红褐色胶体
C.向FeSO4溶液中滴加NaOH溶液,生成的沉淀由白色变成灰绿色,最后变成红褐色
D.SO2使滴有酚酞的NaOH溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O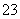 +O2+xOH-===Fe3O4+S4O
+O2+xOH-===Fe3O4+S4O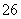 +2H2O,下列说法正确的是
+2H2O,下列说法正确的是
A.x=2
B.参加反应的Fe2+全部做还原剂
C.每生成1 mol Fe3O4,被S2O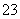 还原的O2为0.5 mol
还原的O2为0.5 mol
D.1 mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的K2Cr2O7溶液完全反应。已知Na2SO3可被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为
A.+2 B.+3
C.+4 D.+5
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氯气和氨气的发生装置,D为纯净、干燥的氯气与氨气反应的装置。
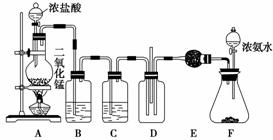
请回答下列问题:
(1)实验室用二氧化锰和浓盐酸反应制取氯气,写出该反应的化学方程式_____________________。
(2)洗气瓶B的作用是_________________________;
C、E都是干燥装置,其中E中干燥管内所装的试剂是________。
(3)反应开始后装置D中出现浓厚的白烟并在容器内壁凝结,活动小组拟继续通过实验鉴定该固体的成分。请你协助他们完成该实验探究。
步骤①:取固体样品加少量水溶解,分装于两支试管中。向其中一支试管中加入浓NaOH溶液,加热,将湿润的红色石蕊试纸放在试管口附近,红色石蕊试纸变蓝,证明该固体中含有_________________________;
步骤②:______________________________。
(4)从绿色化学的角度考虑该装置中有一明显不合理之处,请你提出改进的意见。
查看答案和解析>>
科目:高中化学 来源: 题型:
燃料电池的突出优点是将化学能直接转变为电能,而不经过热能这一中间环节,能量利用率高,已应用于宇宙飞船、航空站及潜水中。氢氧燃料电池可同时供应电和水蒸气,所用燃料为H2,电解质为熔融的K2CO3。已知该电池的正极反应为:
O2 + 2CO2 + 4e- = 2CO32-。
下列叙述正确的是
| A.放电时CO32-向正极移动 B.放电时H2发生还原反应 |
| C.负极反应为H2 + CO32--2e-==H2O + CO2 |
| D.当该电池产生的水蒸气折算成标准状况下的体积为22.4L时,转移电子4mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com