
| A. | 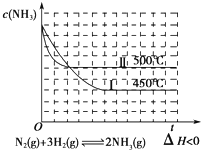 | B. | 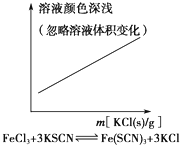 | ||
| C. | 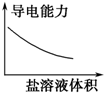 向稀醋酸中加入醋酸钠溶液 | D. | 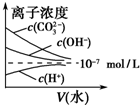 稀释苏打溶液 |
分析 A.合成氨的反应为放热反应,放热反应升高温度平衡向逆方向移动;
B.氯化铁和硫氰酸钾反应生成硫氰酸铁红色溶液,反应实质Fe3++3SCCN-?Fe(SCN)3,改变氯化钾的物质的量,化学平衡不移动;
C.醋酸为弱酸,存在醋酸的电离平衡,依据浓度对平衡移动影响解答;
D.碳酸钠溶液中存在碳酸根离子水解平衡,加水稀释促进碳酸根离子的水解,但醋酸根离子、氢氧根离子浓度减小,由于水的离子积不变,则氢离子浓度增大.
解答 解:A.根据曲线变化可知,500℃达到平衡时氨气的浓度大于450℃的,而合成氨的反应为放热反应,温度越高,达到平衡时氨气的浓度应该越小,图象数据与实际不相符,故A错误;
B.氯化铁和硫氰酸钾反应生成硫氰酸铁红色溶液,存在化学平衡为:Fe3++3SCN-?Fe(SCN)3,加入氯化钾对平衡无影响,溶液颜色不变,图象曲线变化与实际不符,故B错误;
C.醋酸是弱酸,存在电离平衡,只能部分电离出醋酸根离子和氢离子,溶液导电性较弱,加入强电解质醋酸钠后,溶液的导电能力增强,图象变化与实际不相符,故C错误;
D.碳酸钠溶液中碳酸根离子存在水解平衡,加水稀释后促进了碳酸根离子的水解,但平衡状态中碳酸根离子、氢氧根离子浓度都减小,而温度不变则水的离子积不变,由于溶液中氢氧根离子浓度减小,则氢离子浓度增大,图象变化与实际相符,故D正确;
故选D.
点评 本题为图象分析题,解题时准确把握图象含义,明确化学平衡图象、盐类水解平衡、弱电解质平衡、平衡移动原理等知识是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 19g H3O+ 共用的电子对数为8NA | |
| B. | 将含有NO2与N2O4分子共约NA个的混合气,温度降至标准状况,气体体积约为22.4L | |
| C. | 含10.6g Na2CO3溶液中的离子总数为0.3NA | |
| D. | 0℃、101KPa下,22.4L氦气含质子的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
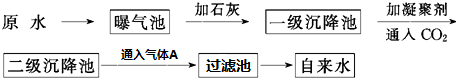
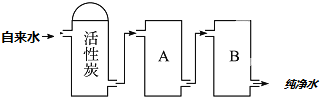
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
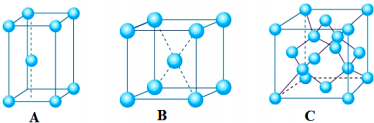
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 观察K2SO4溶液的颜色 | |
| B. | 加水稀释CuSO4溶液,溶液颜色变浅 | |
| C. | 向CuSO4溶液中滴加过量NaOH溶液,振荡后静置,溶液变成无色 | |
| D. | 向CuSO4溶液中滴加过量Ba(NO3)2溶液,振荡后静置,溶液未变成无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 加入的物质 | 结论 | |
| A | 50mL 1mol/L H2SO4 | 反应结束后,c(Na+)=c(SO42-) |
| B | 0.5mol CaO | 若反应完全后溶液的体积仍为100mL,则溶液的pH约为14 |
| C | 50mL H2O | c(Na+)=2[c(CO32-)+c(HCO3-)] |
| D | 0.1mol NaHSO4 | 反应完全后,溶液pH减小,c (Na+)不变 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com