
【题目】在100mL的混合液中,硝酸和硫酸的物质的量浓度分别是0.3molL﹣1、0.15molL﹣1 , 向该混合液中加入2.56g铜粉,加热,待充分反应后,所得溶液中铜离子的物质的量浓度是( )
A.0.15 molL﹣1
B.0.225 molL﹣1
C.0.30 molL﹣1
D.0.45 molL﹣1
【答案】B
【解析】解:n(H+)=0.06mol,n(NO3﹣)=0.03mol,n(Cu)=0.04mol,
由
3Cu+ | 8H++ | 2NO3﹣=3Cu2++2NO↑+4H2O |
3 | 8 | 2 |
则0.04molCu完全反应,需要氢离子为 ![]() >0.06mol,需要硝酸根离子为
>0.06mol,需要硝酸根离子为 ![]() <0.03mol,
<0.03mol,
则氢离子不足,氢离子完全反应,
n(Cu2+)= ![]() =0.025mol,
=0.025mol,
所得溶液中铜离子的物质的量浓度是 ![]() =0.225mol/L,
=0.225mol/L,
故选B.
【考点精析】解答此题的关键在于理解物质的量浓度的概念的相关知识,掌握以单位体积里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度;符号CB=nB(mol)/V(L) (nB是溶质B的物质的量,V是溶液体积),单位是mol·Lˉ1.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】学习小组拟通过实验,探究Mg(NO3)2受热分解的产物.
小组猜想:ⅰ.固体产物可能有Mg(NO2)2、MgO、Mg3N2中的一种或几种
ⅱ.气体产物可能有NO2、N2、O2中的一种或几种
查得相关资料:a.Mg(NO2)2、Mg(NO3)2易溶于水,MgO难溶于水.
b.2NO2+2NaOH═NaNO3+NaNO2+H2O
c.Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑
针对以上猜想,设计了如图所示实验(图中加热、夹持仪器等装置均省略):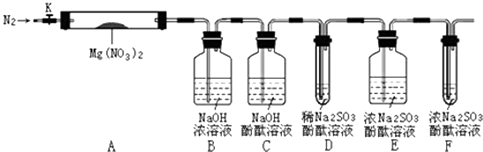
进行实验
Ⅰ.检验上述装置气密性.
Ⅱ.称取3.7gMg(NO3)2固体,置入硬质玻璃管A中,打开K,通入一段时间N2 , 并进行相关物质质量称量
Ⅲ.关闭K,用酒精灯持续给装置A加热,过程中各装置内溶液均未倒吸入其它装置.
Ⅳ.待Mg(NO3)2完全分解,装置冷却至室温,打开K,再缓慢通入一会N2后并再称量.称得A中剩余固体质量为1.0g,B、C、D、E、F中溶液质量分别增加了2.3g、0.0g、0.1g、0.3g、0.05g.
Ⅴ.取少量剩余固体于试管中,加入适量水,未出现明显现象.
回答问题
①小组预测一定有O2生成,理由是 .
②N2的电子式是 , 步骤Ⅱ中,通入一段时间N2的目的是 .
③步骤Ⅲ中,装置A内若出现了红棕色气体,其化学式是 .
④装置C中若红色始终未褪,其设计的目的是 .
⑤实验中发现Mg(NO3)2分解时有O2生成,其实验现象是 , 用化学用语解释产生上述现象的原因是 .
⑥实验中Mg(NO3)2分解没有N2生成的理由是 .
⑦Mg(NO3)2分解的化学方程式是 .
⑧装置F中溶液质量增加的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将三份1mol X气体和3mol Y气体分别充入体积为2L的A,B,C三个容器中,发生反应X(g)+3Y(g)2Z(g).2min后反应达到平衡,测得A中剩余0.4mol X,B中Y的平衡浓度为0.5mol/L,C中用Z表示的反应速率为:v(Z)=0.3mol/(Lmin),则这段时间内三个容器中反应速率的大小关系为( )
A.B>A>C
B.A>B=C
C.B>A=C
D.B>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为配制240mL0.2mol·L-1Na2CO3溶液的示意图。回答下列问题:
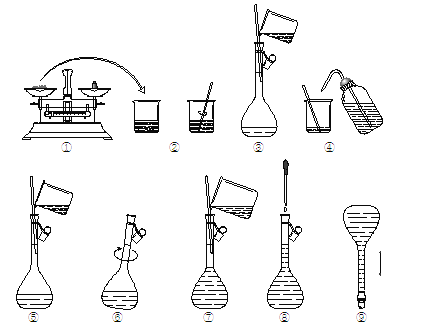
(1)①中称得Na2CO3__________g。
(2)玻璃棒在②、③两步中的作用分别是____________、_____________。
(3)若出现如下情况,对所配溶液浓度有何影响?(填 “偏高”“偏低”或“无影响”)
A.某同学在第⑧步观察液面时时俯视___________;
B.没有进行操作步骤④和⑤ ___________;
C.在第⑤步不慎有少量液体流到容量瓶外_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.常温下,在0.1molL﹣1的HNO3溶液中,由水电离出的c(H+)< ![]()
B.浓度为0.1molL﹣1的NaHCO3溶液:c(H2CO3)>c(CO32﹣)
C.25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同
D.冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( ) 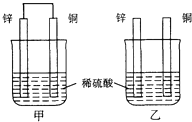
A.两烧杯中铜片表面均无气泡产生
B.两烧杯中溶液的pH均增大
C.甲中铜片是正极,乙中铜片是负极
D.产生气泡的速度甲比乙慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:

(1)该浓盐酸的物质的量浓度为___________mol/L。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是________。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl—的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.3 mol/L的稀盐酸。
①该学生需要用量筒量取___________ mL上述浓盐酸进行配制。
②配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)__________;
A.用约30mL蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量水(约30mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,上下颠倒摇匀
E.改用胶头滴管加蒸馏水,使溶液凹液面最低处恰好与刻度线相切
F.继续往容量瓶内小心加蒸馏水,直到液面接近刻度线1~2cm处
③在配制过程中,下列实验操作对所配制盐酸的浓度有何影响?(用“偏高、偏低或无影响”填空)。
I、用量筒量取浓盐酸时俯视观察凹液面____________;
II、用量筒量取浓盐酸后,洗涤量筒2~3次,洗涤液也转移到容量瓶_________;
III、溶液注入容量瓶前没有恢复到室温就进行定容____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是( )
A.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=﹣4b kJ/mol
B.C2H2(g)+ ![]() O2(g)═2CO2(g)+H2O(l);△H=2b kJ/mol
O2(g)═2CO2(g)+H2O(l);△H=2b kJ/mol
C.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=2b kJ/mol
D.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=b kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com