
硅及其化合物对人类现代文明的发展具有特殊贡献。请回答下列有关问题:
(1)硅原子的结构示意图:________。
(2)下列物品或设备所用的材料属于硅酸盐的是________。
①长江三峡水泥大坝 ②石英光导纤维 ③陶瓷坩埚
④普通玻璃 ⑤硅太阳能电池
A.①②⑤ B.③④⑤ C.②③④ D.①③④
(3)常温下,SiCl4为液态,沸点为57.6 ℃,在空气中冒白雾。制备高纯度硅的中间产物SiCl4中溶有液态杂质,若要得到高纯度SiCl4,应采用的方法是________;用化学方程式及必要文字解释SiCl4在空气中冒白雾的原因:________________________________
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第8讲电化学练习卷(解析版) 题型:选择题
Mg—H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )。

A.Mg电极是该电池的正极
B.H2O2在石墨电极上发生氧化反应
C.石墨电极附近溶液的pH增大
D.溶液中Cl-向正极移动
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第4讲周期律 物质结构练习卷(解析版) 题型:选择题
已知A、B、C、D为短周期主族元素,其相对位置关系如图。C与B可形成离子化合物C3B2。下列分析正确的是( )。

A.电负性:C>A
B.离子氧化性:C>D
C.氢化物稳定性:A>B
D.原子半径:r(C)>r(B)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第2讲化学常用计量练习卷(解析版) 题型:填空题
某同学购买了一瓶××牌“84消毒液”,查阅相关资料和消毒液包装说明得到如下信息:
“84消毒液”:含25%NaClO 1 000 mL、密度1.19 g·cm-3,稀释100倍(体积比)后使用。
请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为________ mol·L-1。
(2)该同学取100 mL该“84消毒液”稀释后用于消毒,稀释后的溶液中
c(Na+)=________ mol·L-1(假设稀释后溶液密度为1.0 g·cm-3)。
(3)某实验需用480 mL含25%NaClO的消毒液。该同学参阅该“84消毒液”的配方,欲用NaClO固体配制该消毒液。
①下列说法正确的是________。

A.如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143 g
②在配制过程中,下列操作可能使配制的溶液的浓度偏大的是________。
A.烧杯中溶液转移到容量瓶中时,未洗涤烧杯
B.定容时,俯视刻度线
C.定容时,仰视刻度线
D.移液时,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第2讲化学常用计量练习卷(解析版) 题型:选择题
设nA为阿伏加德罗常数的数值,下列说法正确的是( )。
A.常温常压下,8 g O2含有4nA个电子
B.1 L 0.1 mol·L-1的氨水中有nA个NH4+
C.标准状况下,22.4 L盐酸含有nA个HCl分子
D.1 mol Na被完全氧化生成Na2O2,失去2nA个电子
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第1讲物质组成性质分类练习卷(解析版) 题型:选择题
下列有关物质分类一定正确的是( )。
①强电解质:氯化氢、氢氧化钡、摩尔盐 ②弱电解质:草酸、纯碱、醋酸铵 ③非电解质:液氨、二氧化硫、苯 ④同系物:CH2O2、C2H4O2、C3H6O2
A.①②③ B.①③ C.①④ D.②③
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第13讲实验方案的设计练习卷(解析版) 题型:填空题
TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
(1)实验室利用反应TiO2(s)+CCl4(g)  TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:
TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:

有关物质性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | -23 | 76 | 与TiCl4互溶 |
TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
仪器A的名称是________。装置E中的试剂是________。反应开始前依次进行如下操作:组装仪器、________、加装药品、通N2一段时间后点燃酒精灯。反应结束后的操作包括:①停止通N2 ②熄灭酒精灯 ③冷却至室温。正确的顺序为________(填序号)。欲分离D中的液态混合物,所采用操作的名称是________。
(2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
酸溶 FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+TiOSO4(aq)+2H2O(l)
水解 TiOSO4(aq)+2H2O(l) H2TiO3(s)+H2SO4(aq)
H2TiO3(s)+H2SO4(aq)
简要工艺流程如下:

①试剂A为________。钛液Ⅰ需冷却至70 ℃左右,若温度过高会导致产品TiO2产率降低,原因是__________________________________________
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是________。这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是____________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第11讲有机化学基础练习卷(解析版) 题型:填空题
某芳香烃A可以从煤干馏得到的煤焦油中分离出来,以A为原料可以合成聚邻氨基苯甲酸、扁桃酸等物质,其合成流程如下。

已知:
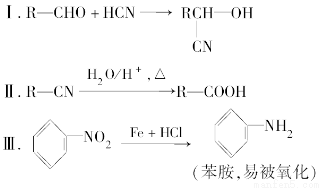
请回答下列问题:
(1)C的分子式为________。
(2)下列对相关反应类型的判断合理的是________(填序号)。
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
Ⅰ | 加成 | 水解 | 还原 | 取代 | 还原 | 氧化 | 加聚 |
Ⅱ | 加成 | 消去 | 还原 | 加成 | 氧化 | 还原 | 缩聚 |
Ⅲ | 取代 | 水解 | 氧化 | 加成 | 氧化 | 还原 | 缩聚 |
Ⅳ | 取代 | 消去 | 氧化 | 取代 | 还原 | 氧化 | 加聚 |
(3)写出反应③的化学方程式:_____________________________________。
(4)扁桃酸有多种同分异构体,其中既能与氯化铁溶液发生显色反应,又能与碳酸氢钠溶液反应产生气泡的同分异构体有________种,写出其中一种的结构简式:________。
(5)以芳香烃A为主要原料,还可以通过下列合成路线合成阿司匹林和冬青油:

①冬青油的结构简式为__________________________________________。
②写出反应Ⅴ的化学方程式:_______________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题7电解质溶液练习卷(解析版) 题型:填空题
某二元酸(化学式用H2B表示)在水中的电离方程式是H2B===H++HB-;HB- H++B2-。回答下列问题。
H++B2-。回答下列问题。
(1)Na2B溶液显_____(填“酸性”、“中性”或“碱性”),理由是_______(用离子方程式表示)。
(2)在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是____。
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
(3)已知0.1 mol·L-1 NaHB溶液的pH=2,则0.1 mol·L-1 H2B溶液中的氢离子的物质的量浓度可能____0.11 mol·L-1(填“<”、“>”或“=”),理由是_____。
(4)0.1 mol·L-1 NaHB溶液中各种离子浓度由大到小的顺序是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com