
| A. | 将铁片换成铁粉 | B. | 把稀硫酸换成浓硫酸 | ||
| C. | 加热 | D. | 加入少量CuO粉末 |
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:4 | B. | 1:5 | C. | 2:1 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平行光照射胶体产生丁达尔效应 | B. | 紫外线照射下,液态蛋白质凝固 | ||
| C. | SO2使品红溶液褪色 | D. | 铁遇到冷的浓硝酸溶液发生钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若△H>0,△S>0,低温时可自发进行 | |
| B. | 若△H<0,△S<0,低温时可自发进行 | |
| C. | 若△H<0,△S>0,任何温度下都能自发进行 | |
| D. | 若△H>0,△S<0,任何温度下都不能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
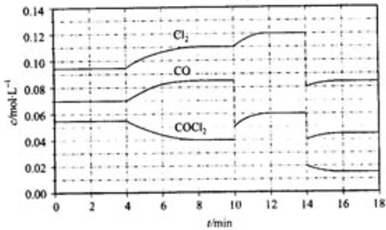
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

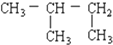

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v正(N2)=v逆(NH3) | B. | v正(N2)=3v正(H2) | ||
| C. | v正(H2)=$\frac{3}{2}$ v逆(NH3) | D. | N2、H2、NH3的体积比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
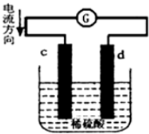 将铜片、锌片插入500mL2mol/L稀硫酸中组成原电池,c、d为两个电极.则下列有关的判断正确的是(溶液体积变化忽略不计)( )
将铜片、锌片插入500mL2mol/L稀硫酸中组成原电池,c、d为两个电极.则下列有关的判断正确的是(溶液体积变化忽略不计)( )| A. | c为负极,其质量逐渐减小,发生还原反应 | |
| B. | 当有0.2mol电子通过电路,正极表明产生气体2.24L | |
| C. | 电池工作的过程中,溶液中SO42-浓度逐渐减小 | |
| D. | 当负极质量减轻32.5g时,烧杯中溶液中H+的浓度为2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 普鲁士蓝晶体结构如图所示(每两个立方体中,一个 K+在其中一个立方体中心,另一个则无 K+),下列说法正确的是( )
普鲁士蓝晶体结构如图所示(每两个立方体中,一个 K+在其中一个立方体中心,另一个则无 K+),下列说法正确的是( )| A. | 化学式可以表示为 KFe2(CN)6 | |
| B. | 每一个立方体中平均含有 24 个π键 | |
| C. | 普鲁士蓝不属于配位化合物 | |
| D. | 每个 Fe3+周围与之相邻的 Fe2+离子有 12 个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com