
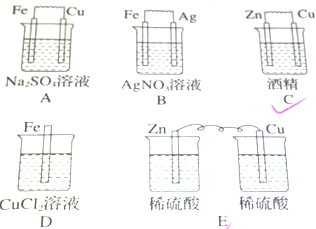
分析 根据原电池的构成条件分析,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应判断;负极失电子发生氧化反应,正极得电子发生还原反应,据此分析判断.
解答 解:A、不能自发的发生氧化还原反应,不能形成原电池,故A错误;
B、铁为负极,Ag为正极,可形成原电池,故B正确;
C、酒精不导电,不能形成原电池,故C错误;
D、没有活泼性不同的2个电极,不能形成原电池,故D错误;
E、没有形成闭合回路,不能形成原电池,故E错误.
AB中负极失电子发生氧化反应,反应式为Fe-2e-=Fe2+,正极得电子发生还原反应,反应式为O2+4e-+2H2O=4OH-、2Ag++2e-=2Ag,
故答案为:B;氧化;Fe-2e-=Fe2+;还原;O2+4e-+2H2O=4OH-、2Ag++2e-=2Ag.
点评 本题考查原电池的组成及工作原理,注意电极反应式的书写方法,牢固掌握原电池中电极的判断,电极反应式的书写的方法,难度不大.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:解答题
 氨气的制取及性质探究(图中夹持装置均已略去).
氨气的制取及性质探究(图中夹持装置均已略去).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .下列有关二甲醚的叙述正确的是( )
.下列有关二甲醚的叙述正确的是( )| A. | 二甲醚是一种有机物,属于非电解质 | |
| B. | 4.6g该物质中含有共价键的数目为2×6.02×1022 | |
| C. | 二甲醚和乙醇互为同分异构体且和甲醇互为同系物 | |
| D. | 标准状况下,燃烧11.2L二甲醚一定生成22.4LCO2 |
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省哈尔滨市高三上学期期中考试化学试卷(解析版) 题型:选择题
燃料电池不是把还原剂、氧化剂全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池。下面有4种燃料电池的工作原理示意图,其中正极的反应产物为水的是

A.固体氧化物燃料电池
B.碱性燃料电池
C.质子交换膜燃料电池
D.熔融盐燃料电池
查看答案和解析>>
科目:高中化学 来源:2017届河南省南阳市高三上学期第三次月考化学试卷(解析版) 题型:选择题
SO2通入足量的Fe(NO3)3稀溶液中,溶液由棕色变为浅绿色,但立即又变成棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。针对上述一系列变化,下列说法不正确的是
A.上述过程中,最终被还原的是NO3-
B.从上述反应可以得出结论,氧化性:HNO3>Fe3+>稀硫酸
C.上述过程中,会产生一种无色难溶于水的气体
D.假设通入的SO2完全反应,则同温同压下,SO2和逸出气体的体积比为1∶1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省长春市高二上学期期初考试化学试卷 题型:选择题
水溶液X中只可能溶有K+、Mg2+、Al3+、AlO 、SiO
、SiO 、CO
、CO 、SO
、SO 中的若干种离子。某同学对该溶液进行了如下实验:
中的若干种离子。某同学对该溶液进行了如下实验:
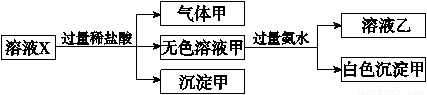
下列判断正确的是
A.白色沉淀甲是混合物
B.沉淀甲是硅酸和硅酸镁的混合物
C.K+、AlO 和SiO
和SiO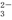 一定存在于溶液X中
一定存在于溶液X中
D.CO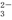 和SO
和SO 一定不存在于溶液X中
一定不存在于溶液X中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com