
分析 根据题中数据计算出该反应的焓变,然后写出反应的热化学方程式;根据盖斯定律及题中热化学方程式计算出反应的热量.
解答 解:在101kPa(25℃时)时,已知0.5mol液态肼与足量氧气反应,生成氮气和水蒸气,放出312KJ的热量,则1mol液态肼完全反应生成氮气和水蒸气放出的热量为:312kJ×2=624kJ,该反应的热化学方程式为:N2H4(1)+O2(g)=N2(g)+2H2O(g)△H=-624kJ/mol;如果生成液态水,1mol肼完全反应放出的热量为:624kJ+44×2kJ=712kJ,64g液态肼完全反应生成氮气和液态水放出的热量为:712kJ×$\frac{64g}{32g/mol×1mol}$=1424kJ,
故答案为:N2H4(1)+O2(g)=N2(g)+2H2O(g)△H=-624kJ/mol;1424.
点评 本题考查了热化学方程式的书写及计算,题目难度中等,注意掌握电子式的概念及书写原则,明确热化学方程式的书写原则及反应热的计算方法.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
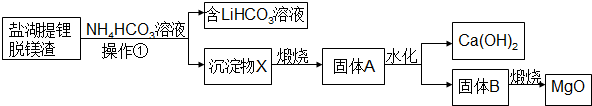
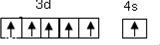 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
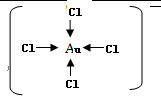
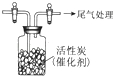 某学习小组推测SO2能与强氧化剂Cl2反应生成SO2Cl2,为此进行探究.
某学习小组推测SO2能与强氧化剂Cl2反应生成SO2Cl2,为此进行探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发新能源,如太阳能、风能等,减少对化石能源的依赖,也减少对大气的污染 | |
| B. | 农作物收割后留下的秸秆可以就地焚烧 | |
| C. | 实施“煤改气”、“煤改电”等清洁燃料改造工程,有利于保护环境 | |
| D. | 汽油发动机工作时会产生少量NO和CO,采用催化反应装置可以减少污染物排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 获得新核素${\;}_{113}^{278}$Ja的过程,是一个化学变化 | |
| B. | 题中涉及的三种元素,都属于金属元素 | |
| C. | 这种超重核素${\;}_{113}^{278}$Ja的中子数与质子数只差为52 | |
| D. | 这种新核素,是同主族元素中原子半径最大的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
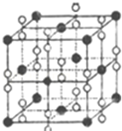 氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .下列关于靛蓝的叙述中错误的是( )
.下列关于靛蓝的叙述中错误的是( )| A. | 靛蓝由碳、氢、氧、氮四种元素组成 | B. | 它的分子式是C16H10N2O2 | ||
| C. | 该物质属于烃 | D. | 它是不饱和的有机物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com