
| A. | △H1<0△H3>0 | B. | △H5<0△H4<△H3 | C. | △H1=△H2+△H3 | D. | △H3=△H4+△H5 |
分析 A.燃烧为放热反应;
B.铝热反应为放热反应,且Al比Fe活泼,Al燃烧放出热量多;
C.3H2 (g)+Fe2O3 (s)=2Fe (s)+3H2O(g)△H2
2Fe (s)+$\frac{3}{2}$O2 (g)=Fe2O3 (s)△H3
由盖斯定律可知,两反应相加得到3H2 (g)+$\frac{3}{2}$O2 (g)=3H2O(g);
D.2Al (s)+$\frac{3}{2}$O2 (g)=Al2O3 (s)△H4
2Al (s)+Fe2O3 (s)=Al2O3 (s)+2Fe (s)△H5
由盖斯定律可知,两反应相减得到2Fe (s)+$\frac{3}{2}$O2 (g)=Fe2O3 (s).
解答 解:A.燃烧为放热反应,则△H1<0、△H3<0,故A错误;
B.铝热反应为放热反应,且Al比Fe活泼,Al燃烧放出热量多,则△H5<0、△H4<△H3,故B正确;
C.3H2 (g)+Fe2O3 (s)=2Fe (s)+3H2O(g)△H2
2Fe (s)+$\frac{3}{2}$O2 (g)=Fe2O3 (s)△H3
由盖斯定律可知,两反应相加得到3H2 (g)+$\frac{3}{2}$O2 (g)=3H2O(g),则3△H1=(△H2+△H3)×2,故C错误;
D.2Al (s)+$\frac{3}{2}$O2 (g)=Al2O3 (s)△H4
2Al (s)+Fe2O3 (s)=Al2O3 (s)+2Fe (s)△H5
由盖斯定律可知,两反应相减得到2Fe (s)+$\frac{3}{2}$O2 (g)=Fe2O3 (s),则△H3=△H4-△H5,故D错误;
故选B.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、盖斯定律应用、焓变的正负为解答的关键,侧重分析与应用能力的考查,注意选项C为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 甲苯能使酸性高锰酸钾溶液褪色,而苯不能使酸性高锰酸钾溶液褪色 | |
| B. | 苯酚能跟NaOH溶液反应,而乙醇不能与NaOH溶液反应 | |
| C. | 苯与硝酸在加热的条件生成硝基苯,而甲苯在加热条件下与硝酸发生反应生成三硝基甲苯 | |
| D. | 乙炔能发生加成,乙烷不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 | |
| D. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的△H=2×(-57.3)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
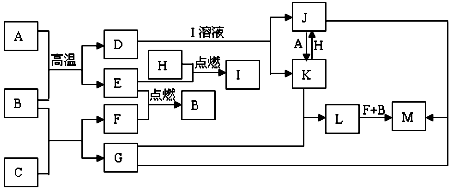
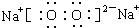 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从溶解的整个过程来看,既包含着物理变化,又包含着化学变化 | |
| B. | 氯化钠溶于水达到饱和后,溶解过程并没有停止 | |
| C. | 氯化钠溶于水中,无论是否形成饱和溶液,都存在溶解与结晶的过程 | |
| D. | 将K37Cl投入到K35Cl的饱和溶液中,溶液中溶质的质量会减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com