
| A. | 含有HCO3-的溶液中:K+、OH-、NO3-、Ca2+ | |
| B. | 滴入KSCN溶液显血红色的溶液中:Na+、Mg2+、SO42-、Br- | |
| C. | 无色并能使石蕊试液变蓝的溶液中:NH4+、Cu2+、NO3-、Cl- | |
| D. | 由水电离的 c(H+)=1.0×10-13mol/L 的溶液中:NH4+、Fe2+、NO3-、SO42- |
分析 A.离子之间结合生成沉淀;
B.滴入KSCN溶液显血红色的溶液,含铁离子;
C.Cu2+为蓝色,能使石蕊试液变蓝的溶液,显碱性;
D.由水电离的 c(H+)=1.0×10-13mol/L 的溶液,为酸或碱溶液.
解答 解:A.OH-、HCO3-、Ca2+结合生成沉淀和水,不能共存,故A不选;
B.滴入KSCN溶液显血红色的溶液,含铁离子该组离子之间不反应,可大量共存,故B选;
C.Cu2+为蓝色,与无色不符,能使石蕊试液变蓝的溶液,显碱性,不能大量存在NH4+、Cu2+,故C不选;
D.由水电离的 c(H+)=1.0×10-13mol/L 的溶液,为酸或碱溶液,碱溶液中不能大量存在NH4+、Fe2+,酸溶液中Fe2+、NO3-发生氧化还原反应不能共存,故D不选;
故选B.
点评 本题考查离子共存,为高频考点,把握习题中的信息、离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应、复分解反应的判断,题目难度不大.


科目:高中化学 来源: 题型:解答题
 乙醇可用来制取乙醛、乙醚、乙酸乙酯等化工原料,也是制取染料、涂料、洗涤剂等产品的原料.
乙醇可用来制取乙醛、乙醚、乙酸乙酯等化工原料,也是制取染料、涂料、洗涤剂等产品的原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 异戊二烯( )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 | |
| B. | 甲苯在一定条件下发生硝化生成一硝基甲苯的反应 | |
| C. | 1-丁烯(CH3CH2CH═CH2)与HCl分子发生的加成反应 | |
| D. | 苯甲酸(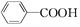 )与NaHCO3溶液反应 )与NaHCO3溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验编号 | 试剂X | MnSO4/g |
| 1 | 锌粉 | 2.4 |
| 2 | 铁粉 | 2.7 |
| 3 | FeS粉末 | 3.0 |
| 4 | 30%过氧化氢 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 互为同系物的两种有机物化学性质一定相似,互为同分异构体的两种有机物化学性质一定不相似 | |
| B. | 某羧酸酯的分子式为C57H104O6,1mol该酯完全水解可得到1 mol甘油 [HOCH2CH(OH)CH2OH]和3mol羧酸,则该羧酸的分子式为C18H36O2 | |
| C. | 有机物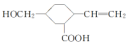 在一定条件下可发生加成反应、聚合反应、水解反应和氧化反应 在一定条件下可发生加成反应、聚合反应、水解反应和氧化反应 | |
| D. | 与 互为同分异构体,且苯环上的一氯代物只有1种,这样的有机物共有7种 互为同分异构体,且苯环上的一氯代物只有1种,这样的有机物共有7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1 mol•L-1 FeCl3溶液中:K+、NH4+、I-、SCN- | |
| B. | 使甲基橙显红色溶液中:K+、Na+、Cu2+、SO42- | |
| C. | 常温下Kw/c(H+)=0.1 mol/L的溶液:K+、Na+、SiO32-、NO3- | |
| D. | 加入铝粉放出大量氢气的溶液:Fe2+、Na+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(金刚石)和CO2 | B. | NaBr和HBr | C. | Cl2和KCl. | D. | CH4和H2O? |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 该分子中含有1个手性碳原子 | |
| B. | 能发生氧化、取代、加成反应 | |
| C. | 1mol该化合物与足量NaOH溶液反应,最多消耗4molNaOH | |
| D. | 1mol该化合物与足量浓溴水反应,最多消耗1molBr2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com