
下列物质的分类正确的是()
碱 酸 盐 碱性氧化物 酸性氧化物
A Na2CO3 H2SO4 NaOH SO2 CO2
B NaOH HCl NH4Cl Na2O CO
C NH3•H2O CH3COOH NaCl Na2O2 SO2
D KOH HNO3 CaCO3 CaO SO2
A. A B. B C. C D. D
考点: 酸、碱、盐、氧化物的概念及其相互联系.
分析: 酸是能电离出的阳离子全部是H+的化合物;碱是电离出的阴离子全部是OH﹣离子的化合物;盐是电离出阳离子是金属阳离子或铵根离子、阴离子为酸根离子的化合物;酸性氧化物是和碱反应生成盐和水的氧化物,碱性氧化物是能和酸反应生成盐和水的氧化物.
解答: 解:A、碳酸钠属于盐类,不属于碱,氢氧化钠属于碱,二氧化硫是酸性氧化物,故A错误;
B、CO不能和碱之间反应,不属于酸性氧化物,故B错误;
C、过氧化钠可以和酸反应生成盐和水以及氧气,不属于碱性氧化物,故C错误;
D、各物质都符合所属类别的概念,分类正确,故D正确.
故选D.
点评: 本题考查酸碱盐以及氧化物的概念及分类,题目难度不大,解答本题的关键把握相关概念以及物质的组成和俗称.


科目:高中化学 来源: 题型:
实验室用氯酸钾和二氧化锰制取氧气的反应方程式为: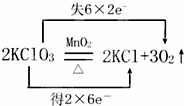 回答下列各题:
回答下列各题:
(1)该反应的基本类型为 .
(2)该反应中被还原的元素名称为 .
(3)式子“失6×2e﹣”中各数字的含义分别是 、 .
(4)从反应后的固体混合物中分离出难溶于水的MnO2操作方法:溶解、过滤、洗涤、干燥
(5)分离出的MnO2可用于实验室制取Cl2,化学方程式为MnO2+4HCl(浓) Cl2↑+MnCl2+2H2O,其离子方程式为 ,反应中浓盐酸表现的性质是(填序号)BC
Cl2↑+MnCl2+2H2O,其离子方程式为 ,反应中浓盐酸表现的性质是(填序号)BC
A 氧化性 B还原性 C酸性
(6)以上两个反应都用到MnO2,其作用分别是 、 .
(7)若两个反应中转移的电子的物质的量相同,则生成的O2和Cl2在相同状况下的体积比为.
查看答案和解析>>
科目:高中化学 来源: 题型:
选择下列实验方法分离物质,将分离方法的序号填在横线上.
A、萃取分液法 B、加热分解C、结晶法D、分液法E、蒸馏法F、过滤法
(1) 分离饱和食盐水和沙子的混合物;
(2) 从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
(3) 用四氯化碳从碘水中提取碘;
(4) 分离四氯化碳(沸点为76.75°C)和甲苯(沸点为110.6°C),已知四氯化碳和甲苯互溶.
查看答案和解析>>
科目:高中化学 来源: 题型:
关于硝酸的说法正确的是()
A. 硝酸电离出的H+离子,能被Zn、Fe等金属还原成H2
B. 浓HNO3与浓HCl按3:1的体积比所得的混合物叫王水
C. 硝酸与金属反应时,主要是+5价的氮元素得电子
D. 常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某主族元素R的气态氢化物中含氢2.47%,该元素的最高价氧化物中含氧37.8%.
(1)计算元素R的相对原子质量;
(2)写出R元素气态氢化物的电子式;
(3)写出R元素最高价氧化物对应的水化物化学式,并指出水化物是酸还是碱.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中属于氧化还原反应,但水没有发生氧化还原反应的是()
A. Cl2+H2O=HCl+HClO B. 2F2+2H2O=4HF+O2
C. Na2O+H2O=2NaOH D. 2Na+H2O=2NaOH+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室中所用氯气是用如下方法制取的4HCl(浓)+MnO2 Cl2↑+MnCl2+2H2O.试回答下列问题:
Cl2↑+MnCl2+2H2O.试回答下列问题:
(1)该反应是氧化还原反应吗? ,如果是氧化还原反应,请指出 是氧化剂, 是还原剂, 是氧化产物, 是还原产物.若标况下生成33.6L Cl2,则该反应中转移 mol电子.
(2)HCl在该反应中的作用为:
(3)氯气溶入水显酸性,写出该反应的离子方程式:Cl2+H2O=H++Cl﹣+HClO;氯气有毒,并有剧烈的刺激性,若吸入大量氯气,可中毒死亡,所以氯气尾气直接排入大气中,会污染环境.实验室中可采用NaOH溶液来吸收有毒的氯气,相关的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族; X+与M2﹣具有相同的电子层结构;离子半径:Z2﹣>W﹣;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料.下列说法中,正确的是( )
|
| A. | X、M两种元素只能形成X2M型化合物 |
|
| B. | 由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低 |
|
| C. | 元素Y、Z、W的单质晶体属于同种类型的晶体 |
|
| D. | 元素W和M的某些单质可作为水处理中的消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用一定体积的浓度为18mol•L﹣1浓硫酸配制100mL3.0mol•L﹣1稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解④转移、洗涤 ⑤定容 ⑥摇匀
按要求回答下列问题:
(1)所需浓硫酸的体积是 取浓硫酸所用的量筒的规格是B.
从下列选项中选择:A.10mL B.25mL C.50mL D.100mL.
(2)对所配制的稀硫酸进行测定,发现其浓度大于3mol/L,配制过程中下列各项操作可能引起该误差的原因有
A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
B.定容时,俯视容量瓶刻度线进行定容
C.将稀释后的稀硫酸立即转入容量瓶后,紧接着就进行以后的实验操作
D.转移溶液时,不慎有少量溶液洒到容量瓶外面
E. 容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
F.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
(3)将正确配制的上述溶液取出10mL,将此10mL溶液稀释至1L,则硫酸电离出的H+物质的量浓度为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com