
| A. | 纤维素 | B. | 蛋白质 | C. | 聚乙烯 | D. | 淀粉 |
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:选择题
| A. | 若X+和Y2-的核外电子层结构相同,则原子序数:X>Y | |
| B. | 元素周期表中位于金属和非金属分界线附近能找到半导体的元素 | |
| C. | Cs和Ba分别位于第六周期IA和IIA族,碱性:CsOH>Ba(OH)2 | |
| D. | 由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
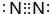 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
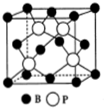 氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
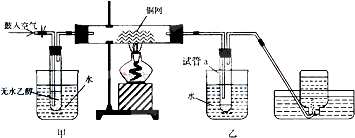
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com