
【题目】一元酯G是一种重要的化工产品,可以丁二烯为原料通过以下系列化学反应得到。

请完成下列各题:
(1)写出反应类型:反应①___________反应④__________反应③____________
(2)写出反应条件:反应③________________反应⑥__________________
(3)反应②③的目的是:___________________________________________。
(4)写出反应⑤的化学方程式:_____________________________________。
(5)写出B与足量氧气在Cu催化下,被氧化成醛的化学反应方程式_____________, 1mol 该醛与足量的银氨溶液反应,可生成Ag的物质的量为________mol。
(6)写出G的结构简式_______________________________________________。
【答案】 加成反应 取代反应 消去反应 NaOH/醇溶液(或KOH醇溶液),加热 NaOH/水溶液,加热 防止双键被氧化 CH2=CHCH2Br+HBr→CH2Br-CH2-CH2Br ![]() 4 HOCH2CH2CH2OOCCH=CHCOOH
4 HOCH2CH2CH2OOCCH=CHCOOH
【解析】由流程中CH2=CH-CH=CH2(1,3-丁二烯)发生反应①生成A,A又转化为HOCH2CH=CHCH2OH,可得:1,3-丁二烯与卤素单质(如Cl2)发生1,4-加成反应生成A(如ClCH2CH=CHCH2Cl),A在氢氧化钠水溶液中加热,水解生成HOCH2CH=CHCH2OH;HOCH2CH=CHCH2OH与HCl发生加成反应生成B为HOCH2CH2CH(Cl)CH2OH;D酸化得到C4H4O4,则D应为盐,结合流程中B→C→D→E的转化可得:C4H4O4为HOOC-CH=CH-COOH,B发生催化氧化生成C为HOOCCH2CH(Cl)COOH,C在氢氧化钠醇溶液中加热发生消去反应生成D为NaOOC-CH=CH-COONa;CH2=CHCH3与溴单质发生α-H取代反应生成CH2=CHCH2Br,CH2=CHCH2Br与HBr发生加成反应生成F为BrCH2CH2CH2Br,F在氢氧化钠水溶液中加热,水解生成HOCH2CH2CH2OH;HOCH2CH2CH2OH与HOOC-CH=CH-COOH发生酯化反应生成G。
(1)由上述分析可知,反应①为1,3-丁二烯与卤素单质发生1,4-加成反应,故反应类型为加成反应;反应④为CH2=CHCH3与溴单质发生α-H取代反应,故反应类型为取代反应;反应③为HOOCCH2CH(Cl)COOH在氢氧化钠醇溶液、加热条件下发生消去反应生成NaOOC-CH=CH-COONa,故反应类型为消去反应。
(2)由上述分析知,反应③的反应条件为:NaOH/醇溶液(或KOH醇溶液)、加热;反应⑥为BrCH2CH2CH2Br水解生成HOCH2CH2CH2OH,故反应条件为:氢氧化钠水溶液、加热。
(3)HOCH2CH=CHCH2OH变为E(HOOCCH=CHCOOH)需要发生氧化反应,而碳碳双键和羟基都容易被氧化,故反应②③的目的是:保护碳碳双键,防止被氧化。
(4)由前面的分析知,反应⑤为:CH2=CHCH2Br与HBr发生加成反应生成F(BrCH2CH2CH2Br),故化学方程式为:CH2=CHCH2Br+HBr→BrCH2CH2CH2Br。
(5)B为HOCH2CH2CH(Cl)CH2OH,与足量氧气在Cu催化下,2个醇羟基都被氧化成醛基,故化学反应方程式为:HOCH2CHClCH2CH2OH+O2![]() OHCCHClCH2CHO+2H2O;OHCCHClCH2CHO与足量的银氨溶液反应化学方程式为:OHCCHClCH2CHO+4Ag[(NH3)2OH]→H4NOOCCHClCH2OONH4+4Ag+6NH3+2H2O,所以1molOHCCHClCH2CHO与足量的银氨溶液反应,可生成4molAg。
OHCCHClCH2CHO+2H2O;OHCCHClCH2CHO与足量的银氨溶液反应化学方程式为:OHCCHClCH2CHO+4Ag[(NH3)2OH]→H4NOOCCHClCH2OONH4+4Ag+6NH3+2H2O,所以1molOHCCHClCH2CHO与足量的银氨溶液反应,可生成4molAg。
(6)由前面的分析知,HOCH2CH2CH2OH与HOOC-CH=CH-COOH发生酯化反应生成G,由G的分子式为C7H10O5可得其结构简式为:HOCH2CH2CH2OOCCH=CHCOOH。


科目:高中化学 来源: 题型:
【题目】在一定温度下,向KOH溶液中通入11.2L(已换算成标准状况下)氯气恰好完全反应生成二种含氯盐:0.7molKC1、0.2mnolKClO和X。则X是
A. 0.1molKClO3 B. 0.2molKClO3 C. 0.1molKClO4 D. 0.2molKClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,辛是由C元素形成的单质,常温常压下乙为液态。常温下,0.1mol·L-1丁溶液的pH为13。上述各物质间的转化关系如图所示。下列说法正确的是

A. 常温条件下元素A、B所形成化合物的状态一定是气态
B. 1.0 L 0.1mol·L-1戊溶液中阴离子的总物质的量小于0.1mol
C. 1mol甲与足量的乙完全反应共转移了约6.02×1023个电子
D. 元素B、C、D的原子半径由大到小的顺序为r(D)>r(C)>r(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一次有机化学课堂小组讨论中,某同学设计了下列合成路线,你认为不可行的是( )
A. 用氯苯合成环己烯:![]()
B. 用甲苯合成苯甲醇:![]()
C. 用乙烯合成乙酸:![]()
D. 用乙烯合成乙二醇:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100mL 稀HNO3和稀H2SO4组成的混合溶液中,两种酸的物质的量浓度之和为0.4mol/L.向该溶液中加入足量的铜粉后加热,充分反应后,所得溶液中Cu2+的物质的量浓度最大值为(反应前后溶液体积变化忽略不计)
A. 0.15mol/L B. 0.24mol/L C. 0.30mol/L D. 0.36mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】认真观察下列有机化合物,回答下列问题:

(1)D中含有的官能团有_________(填写名称,下同),E中含有的官能团有_________________。
(2)下列说法中,错误的是_______。
A.A物质属于酚类 B.B物质分子中含有羧基、醇羟基和酚羟基三种官能团
C.C物质的分子式为C8H8O4 D.F分子中只含有酯基一种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油加工能获得多种化工产品,从物质类别上看主要包含烷烃、烯烃和炔烃等。
(1)石油蒸馏可得分子式为C4H6的烃,其结构可能是1-丁炔,也可能是CH2=CHCH=CH2。下列事实能证明是炔烃而不是CH2=CHCH=CH2的是 __________。
①燃烧时有浓烟 ②能使酸性KMnO4溶液褪色 ③所有原子不在同一平面上 ④与足量溴水反应,生成物中只有2个碳原子上有溴原子
A.①② B.②③ C.③④ D.①④
(2)现有A、B两种烃,它们都来源于石化工业,已知A的分子式为C5Hm, 而B的最简式为C5Hn(m、n均为正整数)。
①下列关于烃A和烃B的说法中不正确的是________(填序号)。
A.烃A和烃B可能互为同系物
B.烃A和烃B可能互为同分异构体
C.当m=12时,烃A一定为烷烃
D.当n=11时,烃B可能的分子式有2种
②若烃A为链状烃,且分子中所有碳原子都在同一条直线上, 则A的结构简式为_____。
③若烃A为链状烯烃,分子中所有碳原子一定共平面,在一定条件下,1 molA最多可与1 molH2加成,则A的名称是____________。
(3)乙炔主要来源之一是石化工业,某研究小组同学为了探究乙炔与HBr发生加成反应后的有关产物,进行以下实验:![]() 。
。
①有机混合物可能含有的物质是_____________(写结构简式)。
②控制反应条件,乙炔经过三步反应可合成![]() ,请写出相应反应方程式___________、________、 ________(可不注明反应条件)。
,请写出相应反应方程式___________、________、 ________(可不注明反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,X、W同主族;Y、Z同周期;X、Y、Z三种元素形成一种化合物M,25 ℃时,0.1 molL-1的M溶液中 =1.0×10-12。下列说法正确的是
=1.0×10-12。下列说法正确的是
A. 简单离子半径:Y<Z<W
B. X分別与Z、W形成的化合物中,所含化学键类型相同
C. X、Y形成的最简单化合物的电子式为![]()
D. Z分別与X、W均可形成具有漂白性的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组以硫铁矿烧渣(含 Fe2O3、 Fe3O4、 Al2O3、 CaO、 SiO2 等)为原料制取软磁用 Fe2O3(要求纯度>99.2%, CaO 含量<0.01%)。其工艺流程如下(所加入试剂均稍过量):
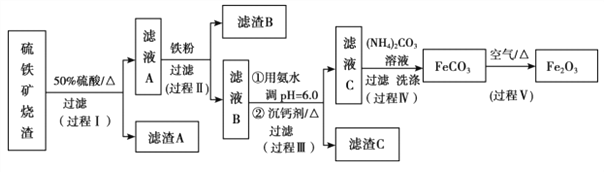
已知:生成氢氧化物的 pH 如下表所示
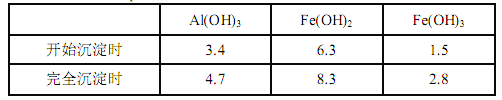
(1)滤渣 A 的主要成分是__________。
(2)在过程Ⅱ中可观察到产生少量气泡,溶液颜色慢慢变浅。能解释该实验现象的离子方程式有__________。
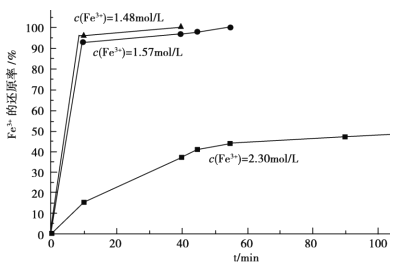
(3)在过程Ⅱ中,课题组对滤液 A 稀释不同倍数后,加入等质量的过量铁粉,得出 Fe3+浓度、还原率和反应时间的关系如图所示:结合上述实验结果说明:课题组选择稀释后c(Fe3+)为 1.60mol/L 左右的理由是______。
(4)在过程Ⅲ中,课题组在相同条件下,先选用了不同沉钙剂进行实验,实验数据见下表:(已知:滤液 B 中钙的含量以 CaO 计为 290—310mg/L)
沉钙剂 | Na2SO3 | H2C2O4 | (NH4)2CO3 | Na2CO3 | NH4F |
用量/g | 2 | 2 | 2 | 5 | 2 |
剩余CaO/mg/L) | 290 | 297 | 290 | 190 | 42 |
根据实验结果, 选择适宜的沉钙剂,得到滤渣 C 的主要成分有__________。
(5)在过程Ⅳ中,反应温度需要控制在 35℃以下,不宜过高,其可能的原因是__________。
(6)在过程Ⅴ中,反应的化学方程式是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com