
硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质)。用该烧渣制取药用辅料——红氧化铁的工艺流程如下:
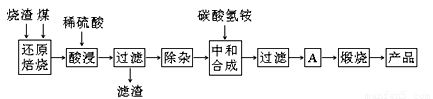
(1)在“还原焙烧”中产生的有毒气体可能有 。
(2)“酸浸”时间一般不超过20 min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因用离子方程式表示: 。
(3)根据下表数据:
|
氢氧化物 |
Al(OH)3 |
Mg(OH)2 |
Fe(OH)3 |
Fe(OH)2 |
|
开始沉淀的pH |
3.10 |
8.54 |
2.01 |
7.11 |
|
完全沉淀的pH |
4.77 |
11.04 |
3.68 |
9.61 |
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于 ,当pH=5时,溶液中c(Al3+)为 mol·L-1(已知常温下Ksp[Al(OH)3]=2.0×10-33)。
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,碳酸氢铵与硫酸亚铁反应的离子方程式为 。
若用等物质的量的碳酸铵替代碳酸氢铵,则产品中可能混有的杂质是 。
(5)A的操作是 。
(6)m g烧渣经过上述工艺可得红氧化铁n g。药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于 (用含m、n的表达式表示)。
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 3.10 | 2.01 | 7.11 |
| 万全沉淀的pH | 4.77 | 3.68 | 9.61 |
查看答案和解析>>
科目:高中化学 来源: 题型:
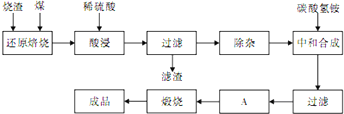
硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质)。用该烧渣制取药用辅料——红氧化铁的工艺流程如下:
(1)在“还原焙烧”中产生的有毒气体可能有 。
(2)“酸浸”时间一般不超过20 min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因用离子方程式表示: 。
(3)根据下表数据:
| 氢氧化物 | Al(OH)3 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 3.10 | 8.54 | 2.01 | 7.11 |
| 完全沉淀的pH | 4.77 | 11.04 | 3.68 | 9.61 |
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于 ,当pH=5时,溶液中c(Al3+)为 mol·L-1(已知常温下Ksp[Al(OH)3]=2.0×10-33)。
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,碳酸氢铵与硫酸亚铁反应的离子方程式为 。
若用等物质的量的碳酸铵替代碳酸氢铵,则产品中可能混有的杂质是 。
(5)A的操作是 。
(6)m g烧渣经过上述工艺可得红氧化铁n g。药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于 (用含m、n的表达式表示)。
查看答案和解析>>
科目:高中化学 来源:2011届福建省宁德市高三普通高中毕业班质量检查(理综)化学部分 题型:填空题
硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质)。用该烧渣制取药用辅料——红氧化铁的工艺流程如下: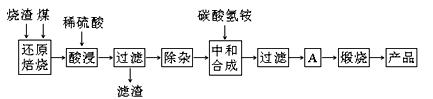
(1)在“还原焙烧”中产生的有毒气体可能有 。
(2)“酸浸”时间一般不超过20 min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因用离子方程式表示: 。
(3)根据下表数据:
| 氢氧化物 | Al(OH)3 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 3.10 | 8.54 | 2.01 | 7.11 |
| 完全沉淀的pH | 4.77 | 11.04 | 3.68 | 9.61 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查阅资料:CaO、MgO在高温下与C难反应,但能与SiO2反应。硫铁矿烧渣是一种工业废渣(含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质),该烧渣可用于制取氧化铁,具体化工生产工艺流程如下:
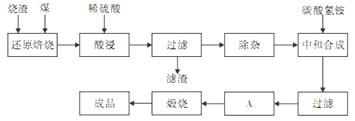
(1)焙烧时产生的主要有害气体是 。
(2)为测定过滤所得滤液中Fe2+的含量,实验室中常用酸性高锰酸钾溶液进行滴定,写出该反应的离子方程式: ;实验中所用酸性高锰酸钾溶液浓度为0.10mol/L,滤液用 滴定管量取20.00ml,用酸性高锰酸钾溶液滴定到终点时消耗了标准的酸性高锰酸钾溶液12.04ml,滤液中c(Fe2+)= 。
(3)若在空气中“酸浸”时间过长,溶液中Fe2+含量将下降,其原因是: (用离子方程式表示)。
(4)根据下表数据:

在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于 ,检验Fe3+已经除尽的试剂是 (除KSCN外)。
(5)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则A的操作是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com