
| A.0.06mol | B.0.12mol | C.0.18mol | D.0.20mol |
科目:高中化学 来源:不详 题型:填空题
| 组别 | | | | |
| V[FeCl3(aq)]/mL | 50 | 50 | 50 | 50 |
| 混合粉末质量/g | 1.2 | 2.4 | 3.6. | 4.8 |
| 反应后剩余固体质量/g | 0 | 0.64 | 1.92 | 3.12 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
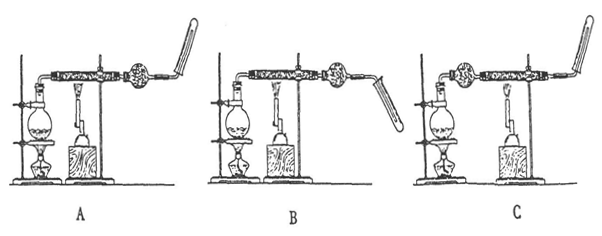 (1)请指出能正确得出实验结论的装置(填"A"、"B"或"C") 。
(1)请指出能正确得出实验结论的装置(填"A"、"B"或"C") 。查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
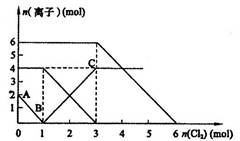
 2Fe3++2Br- 2Fe3++2I-
2Fe3++2Br- 2Fe3++2I- 2Fe2++I2
2Fe2++I2查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 _______(填字母)。
_______(填字母)。| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铁是地壳中含量最高的 金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对;有 |
| B | 常温下铁与稀硫酸反应 生成氢气 | 高温下氢气能还原氧化 铁得到铁 | Ⅰ对;Ⅱ对;无 |
| C | 铁属于过渡元素 | 铁和铁的某些化合物可用作催化剂 | Ⅰ错;Ⅱ对;无 |
| D | 在空气中铁的表面能形 成致密的氧化膜 | 铁不能与氧气反应 | Ⅰ对;Ⅱ对;有 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com