
| A. | 100ml0.1mol•L-1Na2SO4溶液中,微粒总数是0.03NA | |
| B. | 标准状况下,分子数为NA的N2、C2H4混合气体的质量无法确定 | |
| C. | 常温常压下,32g O2-中所含电子的数目为17NA | |
| D. | 标准状况下,11.2L酒精含有的分子数为0.5NA |
分析 A.水分子也属于微粒,无法计算硫酸钠溶液中含有微粒数目;
B.二者的摩尔质量都是28g/mol,分子数为NA的N2、C2H4混合气体的物质的量为1mol,能够根据m=nM计算该混合气体的质量;
C.O2-离子中含有17个电子,根据n=$\frac{m}{M}$计算出32gO2-的物质的量,然后可计算出含有电子的物质的量及数目;
D.标准状况下,酒精的状态不是气态.
解答 解:A.100ml0.1mol•L-1Na2SO4溶液中含有0.01mol硫酸钠,含有0.02mol钠离子和0.01mol硫酸根离子,总共含有0.03mol离子,而硫酸钠溶液中的微粒包含水分子,所以该溶液中含有微粒的总物质的量大于0.03mol,故A错误;
B.分子数为NA的N2、C2H4混合气体的物质的量为1mol,N2、C2H4的摩尔质量相等,都是28g/mol,所以该混合气体的质量为:28g/mol×1mol=28g,故B错误;
C.32g O2-的物质的量为:$\frac{32g}{32g/mol}$=1mol,1mol该离子中含有17mol电子,所含电子的数目为17NA,故C正确;
D.标况下酒精不是气体,不能使用标况下的气体摩尔体积计算,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的综合应用,题目难度不大,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | B的物质的量浓度 | B. | 混合气体的压强不变 | ||
| C. | 混合气体的密度 | D. | 混合气体的相对分子质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
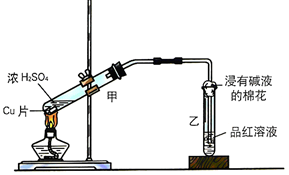
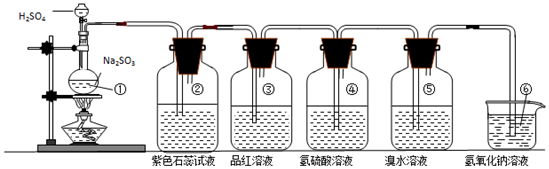
| 装置序号 | 实验现象或作用 | 实验结论或化学方程式 |
| ① | 有气泡产生 | 化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑ |
| ② | 紫色石蕊试液变红色 | 证明SO2溶于水显酸性 |
| ③ | 品红溶液褪色 | 证明SO2具有漂白性 |
| ④ | 溶液变浑浊 | 证明SO2具有氧化性 |
| ⑤ | 溴水褪色 | 证明SO2具有还原性 |
| ⑥ | 吸收尾气 | 证明SO2属于酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 62g白磷(白磷P4为正四面体结构P原子位于顶点)中含P-P共价键为6NA | |
| B. | 1molCl2全部发生反应时,无论什么时候都是得到的电子数一定为2NA | |
| C. | 若一个CO的质量为a g,则CO的摩尔质量为a NA | |
| D. | 常温下10LpH=13的NaOH溶液中含有的OH-离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
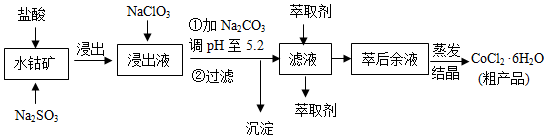
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,NA个H2O 分子所占体积约为22.4L | |
| B. | 0.1 mol H2、0.2 mol O2、0.3 mol N2和0.4 mol CO2组成的混合气体在标准状况下的体积约为22.4 L | |
| C. | 常温常压下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1 NA | |
| D. | 0.5mol/L的NaCl溶液中Cl-的个数为是0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
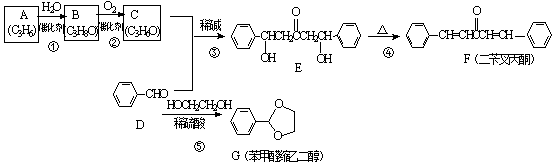
 ;A加聚产物的结构简式是
;A加聚产物的结构简式是 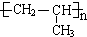 .
.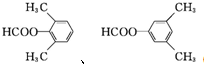 .
.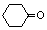 (环已酮)合成
(环已酮)合成 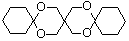 [已知HCHO是所有醛中还原性最强的(常用Ca(OH)2催化剂)]
[已知HCHO是所有醛中还原性最强的(常用Ca(OH)2催化剂)]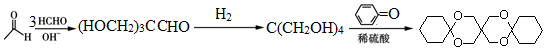 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
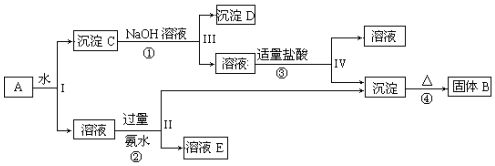
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com