
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源.
(1)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.已知:H2(g)+Cl2(g)=2HCl(g)△H=﹣a kJmol﹣1;E(H﹣H)=b kJmol﹣1 , E(Cl﹣Cl)=c kJmol﹣1 , 则:E(H﹣Cl)=;
(2)氯原子对O3的分解有催化作用:O3(g)+Cl(g)=ClO(g)+O2(g)△H1 , ClO(g)+O(g)=Cl(g)+O2(g)△H2 , 大气臭氧层的分解反应是O3+O=2O2△H.该反应的能量变化示意图如图1所示.则反应O3(g)+O(g)=2O2(g)的正反应的活化能为kJmol﹣1 . 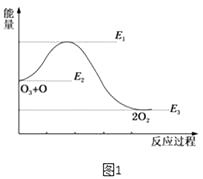
(3)实验中不能直接测出由石墨和氢气反应生成甲烷反应的反应热,但可测出CH4、石墨和H2燃烧反应的反应热,求由石墨生成甲烷的反应热.已知:
①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣a kJmol﹣1
②C(石墨)+O2(g)═CO2(g)△H=﹣b kJmol﹣1
③H2(g)+ ![]() O2(g)═H2O(l)△H=﹣c kJmol﹣1
O2(g)═H2O(l)△H=﹣c kJmol﹣1
则反应C(石墨)+2H2(g)→CH4(g)的反应热:
△H=kJmol﹣1 .
又已知:该反应为放热反应,△H﹣T△S可作为反应方向的判据,当△H﹣T△S<0时可自发进行;则该反应在什么条件下可自发进行 . (填“低温”、“高温”)
(4)有图2所示的装置,该装置中Cu极为极;当铜片的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为L. 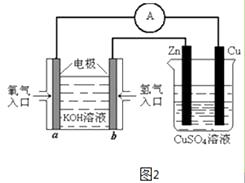
【答案】
(1)![]() KJ/mol
KJ/mol
(2)E1﹣E2
(3)(﹣2c﹣b+a)kJ?mol﹣1;低温
(4)阳;2.24
【解析】解:(1)由于反应热=反应物的键能﹣生成物的键能,设E(H﹣Cl)为Xmol,故有:E(H﹣H)+E(Cl﹣Cl)﹣2X=﹣akJ/mol,即bkJ/mol+ckJ/mol﹣2X=﹣aKJ/mol
解得X= ![]() KJ/mol,所以答案是:
KJ/mol,所以答案是: ![]() KJ/mol;(1)(a+b+c)/2 kJmol﹣1 , (2)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据图象能量关系可知,正反应的活化能=E1﹣E2;
KJ/mol;(1)(a+b+c)/2 kJmol﹣1 , (2)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据图象能量关系可知,正反应的活化能=E1﹣E2;
所以答案是:E1﹣E2;(3)已知①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣a kJmol﹣1②C(石墨)+O2(g)═CO2(g)△H=﹣b kJmol﹣1③H2(g)+ ![]() O2(g)═H2O(l)△H=﹣c kJmol﹣1
O2(g)═H2O(l)△H=﹣c kJmol﹣1
由盖斯定律可知,②+2×③﹣①可得C(石墨,s)+2H2(g)═CH4(g)△H=(﹣2c﹣b+a) kJmol﹣1 ,
又该反应为放热反应,△H<0,又△S<0,所以该反应在低温下△H﹣T△S<0可自发进行;
所以答案是:(﹣2c﹣b+a) kJmol﹣1;低温;(4)装置图可知左边为原电池,是氢氧燃料电池,氧气一端为原电池正极,氢气一端电极为原电池负极,右边装置为电解池,与a相连的铜电极为阳极,与b电极连接的锌电极为电解池的阴极,当铜片的质量变化为12.8g时物质的量= ![]() =0.2mol,依据电极反应和电子守恒计算得到,铜电极电极反应:Cu﹣2e﹣=Cu2+;a电极反应为O2+2H2O+4e﹣=4OH﹣ , 依据电子守恒得到O2~2Cu,a极上消耗的O2物质的量为0.1mol,标准状况下的体积=0.1mol×22.4L/mol=2.24L,
=0.2mol,依据电极反应和电子守恒计算得到,铜电极电极反应:Cu﹣2e﹣=Cu2+;a电极反应为O2+2H2O+4e﹣=4OH﹣ , 依据电子守恒得到O2~2Cu,a极上消耗的O2物质的量为0.1mol,标准状况下的体积=0.1mol×22.4L/mol=2.24L,
所以答案是:阳;2.24.


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】V mL Al2(SO4)3溶液中含Al3+a g,取 ![]() mL溶液稀释到4 V mL,则稀释后溶液中SO
mL溶液稀释到4 V mL,则稀释后溶液中SO ![]() 的物质的量浓度是( )
的物质的量浓度是( )
A.![]() mol·L-1
mol·L-1
B.![]() mol·L-1
mol·L-1
C.![]() mol·L-1
mol·L-1
D.![]() mol·L
mol·L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗铜精炼后的阳极泥含有Cu、Au(金)和PbSO4等杂质,湿法处理阳极泥进行综合利用的流程如图: 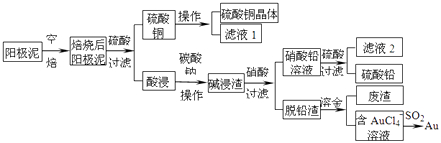
(1)用CuSO4做电解液电解含铜、金、铅的粗铜,阳极的电极反应式有:Pb﹣2e﹣+SO42﹣=PbSO4和 .
(2)碱浸渣的主要成分是、 . (写化学式)
(3)操作I的主要步骤为 .
(4)写出用SO2还原AuCl4﹣的离子方程式 .
(5)为了减少废液排放、充分利用有用资源,工业上将滤液2并入硝酸进行循环操作,请指出流程图中另一处类似的做法 .
(6)已知298K时,Ksp(PbCO3)=1.5×10﹣13 , Ksp(PbSO4)=1.8×10﹣8 , 将1mol PbSO4固体放入1L Na2CO3溶液中,充分反应后达到平衡,溶液中c(CO32﹣)为5mol/L,溶液体积在反应前后保持不变,则平衡后c(SO42﹣)= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A.1 mol H2O的质量为18g/mol
B.CH4的摩尔质量为16g
C.3.01×1023个SO2分子的质量为32g
D.标准状况下,1 mol任何物质体积均为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】30.工业上通过电解饱和的食盐水来制取氯气。现取500ml含NaCl为11.7g的饱和食盐水进行电解,
(1)在标准状况下制得Cl2多少升?
(2)所得NaOH的物质的量浓度为多少?(电解前后溶液体积保持不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学反应与能量的下列说法不正确的是
A. 化学反应伴随能量变化B. 光合作用实现能量转化
C. 铝和盐酸反应为放热反应D. 能量降低的反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X,Y,Z是三种短周期的主族元素,在周期表的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( ) 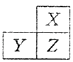
A.原子半径:Y>Z>X
B.气态氢化物的热稳定性:X<Z
C.y和z的最高价氧化物对应水化物均为强酸
D.若z的最高正价为+m,则X的最高正价也一定为+m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知含氧酸可用通式XOm(OH)n表示,如X是S,m=2,n=2,则这个式子表示为H2SO4 . 一般而言,该式子中m大的是强酸,m小的是弱酸.下列各含氧酸中酸性最强的是( )
A.HClO3
B.H2SeO3
C.H3PO4
D.HMnO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com