
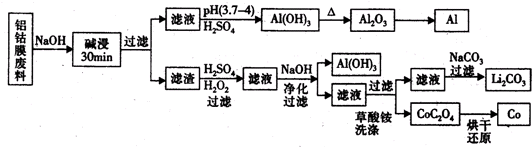
| ||
| ||


科目:高中化学 来源: 题型:
| 化学方程式 | K(t1) | K(t2) |
| F2+H2?2HF | 1.8×1036 | 1.9×1032 |
| Cl2+H2?2HCl | 9.7×1012 | 4.2×1011 |
| Br2+H2?2HBr | 5.6×107 | 9.3×106 |
| I2+H2?2HI | 43 | 34 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、葡萄糖注射液不能产生丁达尔效应,不属于胶体 |
| B、可用蘸浓盐酸的棉棒检验输送氨气的管道是平否漏气 |
| C、明矾和漂白粉常用于自来水的净化和杀菌流消毒,两者原理相同 |
| D、化学变化中一定有能量变化,而有能量变化过程不一定发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、向CaCl2溶液中通入CO2至过量 |
| B、向澄清石灰水中通入CO2至过量 |
| C、向Na2SiO3溶液中通入CO2至过量 |
| D、AlCl3溶液滴加NaOH溶液至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
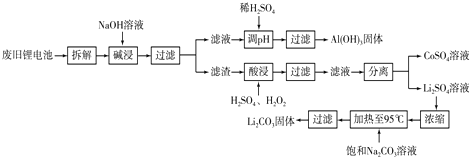
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△H1>△H3>△H2=-57.3 kJ?mol-1 |
| B、△H2<△H1=-57.3 kJ?mol-1<△H3 |
| C、△H1>△H3=-57.3 kJ?mol-1>△H2 |
| D、△H1<△H3=-57.3 kJ?mol-1<△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化镁、氧化铝的熔点都很高,都可用作耐高温材料 |
| B、二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
| C、品红溶液通入二氧化硫,品红褪色,再加热不恢复红色 |
| D、锌的金属活泼性比铁强,可在海轮外壳上装若干锌块以减缓其腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com