
| A. | 在水中溶解性:Na2CO3<NaHCO3 | |
| B. | 与酸反应的剧烈程度:Na2CO3<NaHCO3 | |
| C. | 热稳定性:Na2CO3>NaHCO3 | |
| D. | 二者间在一定条件下可相互转化 |
分析 NaHCO3不稳定,溶解度比Na2CO3小,与盐酸反应较Na2CO3剧烈,可与NaOH反应生成Na2CO3,Na2CO3可与水、二氧化碳反应生成NaHCO3,以此解答该题.
解答 解:A.常温下,向饱和碳酸钠溶液中通入二氧化碳气体,有碳酸氢钠晶体析出,可知常温时水溶解性:Na2CO3>NaHCO3,故A错误;
B.分别滴加HCl溶液,反应离子方程式为CO32-+2H+═CO2↑+H2O,HCO3-+H+═H2O+CO2↑,相同条件下NaHCO3比Na2CO3反应放出气体剧烈,故B正确;
C.因2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,而碳酸钠加热不分解,所以热稳定性:Na2CO3>NaHCO3,故C正确;
D.NaHCO3可与NaOH反应生成Na2CO3,而NaHCO3分解可生成Na2CO3,故D正确,
故选A.
点评 本题考查Na2CO3和NaHCO3性质的异同,题目难度不大,注意把握Na2CO3和NaHCO3性质,注重基础知识的积累.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红热的铜丝在硫蒸汽中燃烧,产生黑色固体 | |
| B. | 碘水中加入少量CCl4,振荡静置后,下层颜色变浅,上层颜色变为紫色 | |
| C. | 往溴水中加入碘化钠溶液,溴水变为无色 | |
| D. | 氢气在Cl2中燃烧产生白色的烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
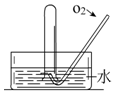 如图所示,将一瓶充满NO2气体的试管倒扣在水槽中,气体颜色由红棕色逐渐变为无色,试管内的液面会逐渐上升;当反应停止后向试管中缓慢通入氧气,气体颜色又由无色逐渐变为红棕色,之后又变为无色,试管内的液面会继续上升.用化学方程式表示试管中发生的化学反应3NO2+H2O=2HNO3+NO,2NO+O2=2NO2、4NO2+O2+2H2O=4HNO3.
如图所示,将一瓶充满NO2气体的试管倒扣在水槽中,气体颜色由红棕色逐渐变为无色,试管内的液面会逐渐上升;当反应停止后向试管中缓慢通入氧气,气体颜色又由无色逐渐变为红棕色,之后又变为无色,试管内的液面会继续上升.用化学方程式表示试管中发生的化学反应3NO2+H2O=2HNO3+NO,2NO+O2=2NO2、4NO2+O2+2H2O=4HNO3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、Br-、SO42- | B. | Na+、Ba2+、ClO-、Cl- | ||
| C. | Ca2+、Cl-、HCO3-、K+ | D. | NH4+、K+、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOCH2CH3 | B. | HCOOH | C. | HOOCCOOH | D. | HCHO |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
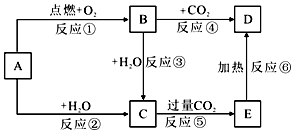
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
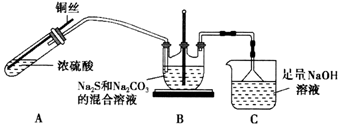
| 序号 | 操作及现象 | 结论 |
| ① | 取少量Al(OH)3粉末于试管中,滴加适量溶液,振荡,白色粉末溶解 | 溶质中一定含有NaOH |
| ② | 取2nL溶液于试管中,滴加足量氯水,氯水褪色丙有气泡产生,再滴加几滴Ba(NO3)2溶液,有白色沉淀产生 | 溶质为NaOH和 Na2CO3、Na2SO3 |
| 取2mL溶液于试管中,若 先加入足量稀硝酸,产生气泡,再滴入几滴Ba(NO3)2溶液,无沉淀产生 | 溶质为为NaOH和Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com