

 ,则E的结构简式为
,则E的结构简式为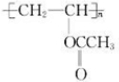 ,结合对应的有机物的结构和性质以及题目要求解答该题.
,结合对应的有机物的结构和性质以及题目要求解答该题. ,
, ,故答案为:
,故答案为: ;
;| CH3CH2OH |
| CH3CH2OH |
 ,
, .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、Ca2+、Na+、NO3-、CO32- |
| B、Mg2+、Cl-、NH4+、SO42- |
| C、K+、Cl-、HCO3-、NO3- |
| D、Ca2+、Na+、Fe2+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃1 L pH=13的Na2CO3溶液中,Na+数目为0.2NA |
| B、2g D2O中,含中子总数为NA |
| C、将H2O2溶液与酸性KMnO4溶液作用,若有1 molO2生成,转移电子数为4NA |
| D、标准状况下,22.4L甲苯中含有C-H键数目为8 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某溶液中所有离子的浓度大小排序是:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),则该溶液的溶质一定是CH3COONa和CH3COOH |
| B、CH3COOH与NaOH的混合溶液显碱性,则溶液中各离子浓度大小排序一定为c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| C、常温下,amol/L的CH3COOH溶液与b mol/L的NaOH溶液等体积混合后溶液的pH=7,则一定有a=b |
| D、常温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后溶液的pH一定等于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | |
| 乙 | H2O | 丙 | |||
| 1 | 650 | 4 | 2 | 1.6 | 5 |
| 2 | 900 | 2 | 1 | 0.4 | 3 |
| 3 | 900 | 2 | 1 | 0.4 | 1 |
| 物质 | 乙 | H2O | 丙 | H2 |
| 起始量/mol | 0.8 | 1.0 | 0.6 | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电池总反应的离子方程式为:Mg+H2O2+2H+=Mg2++2H2O |
| B、正极的电极反应为:H2O2+2H++2e-=2H2O |
| C、工作时,正极周围海水的pH减少 |
| D、电池工作时,溶液中的H+向负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L乙醇中含有的氧原子数为NA |
| B、标准状况下,22.4L37Cl2中所含中子数为4NA |
| C、将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NA个Fe3+ |
| D、25℃时,pH=13的1.0LBa(OH)2溶液中含有OH-数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强酸溶液产生的H2多 |
| B、弱酸溶液产生的H2多 |
| C、两者产生的H2一样多 |
| D、无法比较 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com