
| A. | 称取5 g左右的干海带--托盘天平 | |
| B. | 过滤煮沸后的海带灰和水的混合物--漏斗 | |
| C. | 用蒸发结晶的方法从氧化后的海带灰浸取液中提取碘--蒸发皿 | |
| D. | 用四氯化碳从氧化后的海带灰浸取液中提取碘--长颈漏斗 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流 程示意图如下:
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流 程示意图如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14N和14C属于不同核素,它们互为同位素 | |
| B. | 1H和2H是同种元素,它们核外电子数不相等 | |
| C. | 14C和14N的质量数相等,中子数也相等 | |
| D. | 6Li和7Li的质子数相等,二者互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2O3$\frac{\underline{\;催化剂\;}}{\;}$ 3O2 | |
| B. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe | |
| C. | 3C12+2Fe $\frac{\underline{\;点燃\;}}{\;}$2FeCl3 | |
| D. | 2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=-242 kJ/mol | B. | 2H2(g)+O2(g)═2H2O(l)△H=-484 kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242 kJ/mol | D. | 2H2(g)+O2(g)═2H2O(g)△H=+484 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
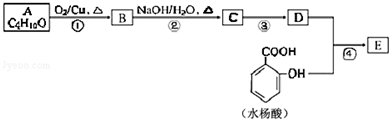
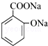
 ;
;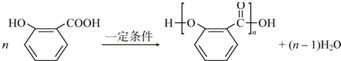 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com