
【题目】下列各组物质中,按单质、化合物、混合物的顺序排序正确的是
A.稀有气体、尿素、冰水混合物
B.乙醇、浓硫酸、胆矾
C.金刚石、铁矿石、大理石
D.水银、水蒸气、水煤气
科目:高中化学 来源: 题型:
【题目】研究PM 2.5、SO2、NOx等,对监测空气质量具有重要意义.取某样本用蒸馏水处理制成待测液,其中所含离子的化学组分及其浓度如下表:
离子 | K+ | Na+ | NH4+ | H+ | SO42﹣ | NO3﹣ | Cl﹣ |
浓度/molL﹣1 | 4×10﹣6 | 6×10﹣6 | 2×10﹣5 | a | 4×10﹣5 | 3×10﹣5 | 2×10﹣5 |
请回答下列问题:
(1)根据表中数据计算此待测液中c(H+)浓度a为mol/L.
(2)NOx是汽车尾气中的主要污染物之一. ①汽车发动机工作时的高温会引发N2和O2反应,反应的化学方程式是 .
②NOx能形成酸雨,由NO2形成酸雨的主要反应是(写离子方程式).
(3)为减少SO2的排放,常采取的措施有: ①在燃煤中加入生石灰可以起到固硫的作用,SO2被吸收后转化成一种硫元素的最高价态的化合物,该物质的化学式是 .
②吸收烟气中的SO2 , 以下物质可作吸收剂的是(填序号);硫酸工业中的尾气SO2可以循环利用,写出SO2转化为SO3反应的化学方程式 . a.NaOH b.H2SO4 c.NaHSO3 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图图示与对应的叙述相符的是( ) 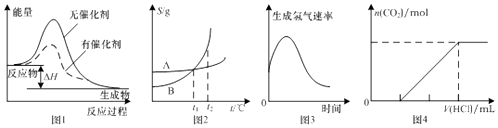
A.图1表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示A,B两物质的溶解度随温度变化情况,将t1℃时A,B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
C.图3表示镁条放入盐酸中生成氢气速率随时间的变化,起初反应速率加快的原因可能是该反应为放热反应
D.图4表示在含等物质的量NaOH,Na2CO3的混合溶液中滴加0.1 molL﹣1盐酸至过量时,产生气体的体积与消耗盐酸的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产生活中有着重要的应用.请按要求写出相应的方程式.
(1)将含SO2的废气通入含Fe2+(催化剂)的溶液中,常温下可使SO2转化为SO24﹣ , 其总反应为2SO2+O2+2H2O=2H2SO4 . 上述总反应分两步进行,第一步反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,写出第二步反应的离子方程式: .
(2)pH=3.6时,碳酸钙与硫酸铝反应可制备碱式硫酸铝[Al2(SO4)x(OH)6﹣2x]溶液.若溶液的pH偏高,则碱式硫酸铝产率降低且有气泡产生,用化学方程式表示其原因: .
(3)ClO2是一种高效安全的杀菌消毒剂.氯化钠电解法生产ClO2工艺原理示意图如下: 
①写出氯化钠电解槽内发生反应的离子方程式: .
②写出ClO2发生器中的化学方程式,并标出电子转移的方向及数目: .
③ClO2能将电镀废水中的CN﹣离子氧化成两种无毒气体,自身被还原成Cl﹣ . 写出该反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A.手性催化剂主要催化一种手性分子的合成
B.原子晶体的熔点一定比金属晶体的高
C.元素电负性越大的原子,吸引电子的能力越强
D.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)由乙烯制取聚乙烯的化学方程: .
(2)写出下列物质的结构简式; ①2,3﹣二甲基戊烷
②3﹣甲基﹣2﹣戊烯
③间二甲苯
(3)分子中含有5个碳原子的链状单炔烃的分子式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关生活中化学的叙述中,正确的是
A.只用米汤就能检验出食盐中是否加碘
B.可用热的纯碱溶液清洗油污
C.“光化学烟雾”的形成与二氧化硫有关
D.用硅单质制光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
(1)常温下,工业上用铁质容器盛放冷的浓硫酸,其原因是 .
(2)称取碳素钢6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y. ①甲同学认为X中除Fe3+之外还可能含有Fe2+ . 若要确认其中的Fe2+ , 应选用(选填序号).
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取560mL(标准状况)气体Y通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g,由此可求算气体Y中SO2的体积分数 .
写出探究②中出现的所有离子反应方程式 .
(3)根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893gL﹣1 . 为此设计了下列探究实验装置(图中夹持仪器省略,假设有关气体完全反应). 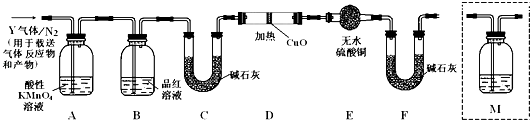
装置B中试剂的作用是 .
(4)分析Y气体中的Q2气体是如何生成的 . (用化学方程式表示).
(5)为确认Q2的存在,需在装置中添加洗气瓶M于(选填序号). a.A之前 b.A﹣B间 c.B﹣C间 d.C﹣D间
(6)如果气体Y中含有Q1 , 预计实验现象应是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com