
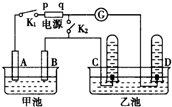
 在图均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重1.6g.请回答下列问题:
在图均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重1.6g.请回答下列问题:分析 (1)A电极表面有红色的固态物质生成,所以A电极是阴极,B电极有无色气体生成,所以B是阳极,所以C是阴极,该电极产生的气体是氢气,D电极是阳极,该极上产生的是氧气,所以q是正极,p是负极,根据电极上离子的放点规律书写电极反应式;
(2)电解硫酸铜生成硫酸、铜和氧气,据此回答;
(3)根据生成的铜的量计算生成硫酸的量,进而计算pH,电解质复原的方法:出什么加什么;
(4)因为可溶性盐,电解时得O2,酸根只有常见的SO42-和NO3-,应从这两个角度去鉴定;
(5)再将K1断开,闭合K2,电流计指针发生偏转,形成氢氧燃料电池,通氧气的是正极,发生得电子的还原反应.
解答 解:A电极表面有红色的固态物质生成,所以A电极是阴极,B电极有无色气体生成,所以B是阳极,所以C是阴极,该电极产生的气体是氢气,D电极是阳极,该极上产生的是氧气,所以q是正极,p是负极,
(1)电解过程中,B是阳极,电极反应式为4OH--4e-=2H2O+O2↑,乙池C电极是阴极,该电极发生反应的电极反应式为:2H++2e-=H2↑,
故答案为:4OH--4e-=2H2O+O2↑;2H++2e-=H2↑;
(2)电解硫酸铜生成硫酸、铜和氧气,甲池电解时反应的离子方程式为:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+,
故答案为:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+;
(3)取出A电极,洗涤、干燥、称量,电极质量增重1.6g,即生成金属铜的物质的量是0.025mol,根据2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+,
生成硫酸中氢离子的物质的量是0.05mol,所以氢离子浓度是$\frac{0.05mol}{0.5L}$=0.1mol/L,pH=1,电解质复原的方法:出什么加什么,要使电解后溶液恢复到电解前的状态,则需加,0.025mol的氧化铜,质量是2g,故答案为:1;CuO;2;
(4)根据两极上的现象,可以推知电解的是可溶性的铜盐溶液,阴离子可以是SO42-或NO3?,故答案为:取少量的待测液于试管中,滴加一定量的盐酸无明显现象,继续滴加氯化钡溶液,若有白色沉淀产生则证明原溶液中有SO42-;
①硫酸根离子的检验方法:取少量的待测液于试管中,滴加一定量的盐酸无明显现象,继续滴加氯化钡溶液,若有白色沉淀产生则证明原溶液中有SO42-,
故答案为:硫酸根离子,取少量的待测液于试管中,滴加一定量的盐酸无明显现象,继续滴加氯化钡溶液,若有白色沉淀产生则证明原溶液中有SO42-;
②硝酸根离子,取少量待测液于试管中,滴加浓硫酸,再撒入铜粉,若有红棕色气体产生,则证明含有硝酸根离子,
故答案为:硝酸根离子,取少量待测液于试管中,滴加浓硫酸,再撒入铜粉,若有红棕色气体产生,则证明含有硝酸根离子;
(5)再将K1断开,闭合K2,电流计指针发生偏转,形成氢氧燃料电池,故答案为:K1断开,闭合K2,乙池形成了H2、O2的燃料电池,从而产生电流.
点评 本题综合考查学生原电池和电解池的工作原理以及电极反应式的书写和计算知识,属于综合知识的考查,知识的归纳和整理是关键,难度不大.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.48 | B. | 3.78 | C. | 10.52 | D. | 10.22 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl- | B. | OH- | C. | [Al(OH)4]- | D. | HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、HCO3-、Cl-、K+ | B. | Al3+、NH4+、CO32-、Cl- | ||
| C. | Ca2+、Na+、NO3-、SO42- | D. | H+、NH4+、I-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成n mol的A2,同时生成n mol的AB | |
| B. | 容器内的总压强不随时间的变化而变化 | |
| C. | 单位时间内生成2n mol的AB同时生成n mol的B2 | |
| D. | 平均相对分子质量不随时间变化而变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸、硫酸、Fe2(SO4)3溶液 | B. | NaCl、KCl、AgNO3溶液 | ||
| C. | NaOH溶液、水玻璃 | D. | MnO2、KClO3、KMnO4固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com