
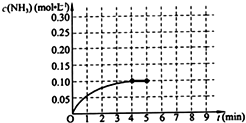
 在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:| △c |
| △t |
| 0.1mol/L |
| 4min |
 ,故答案为:
,故答案为: .
.


科目:高中化学 来源: 题型:

| A、达到平衡后,若使用催化剂,C的体积分数增大 |
| B、达到平衡后,若使温度升高,化学平衡向逆反应方向移动 |
| C、化学方程式中n>c+f |
| D、达到化学平衡后,增加A的量有利于化学平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入烧碱溶液,微热时有气体放出,该气体能使湿润的红色石蕊试纸变蓝,则原溶液中有NH4+ |
| B、加入盐酸无现象,再加BaCl2溶液,有白色沉淀生成,则原溶液中有SO42- |
| C、加入盐酸有无色气体逸出,该气体能使澄清石灰水变浑浊,则原溶液有CO32- |
| D、加入Ba(OH)2溶液,有白色沉淀生成,则原溶液中有 SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
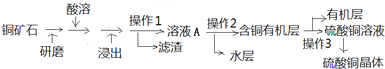
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向氯化铁溶液中滴加HI溶液:2Fe3++2HI=2Fe2++2H++I2 |
| B、1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积均匀混合:2AlO2-+5H+=Al(OH)3↓+Al3++H2O |
| C、向NaAlO2溶液中通入过量CO2制Al(OH)3:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| D、将16.8g 铁粉投入100mL 4.0mol/L的HNO3溶液中(还原产物只有NO)6Fe+20H-+5NO3-=3Fe2++3Fe3++5NO↑+10H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
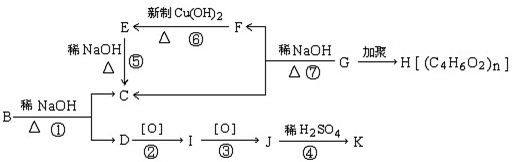
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、平衡混合气中物质A的百分含量 |
| B、平衡混合气中物质B的百分含量 |
| C、平衡混合气的平均摩尔质量 |
| D、平衡混合气的密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
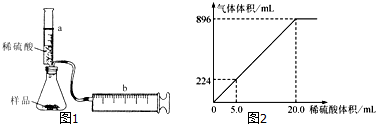
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com